【QAあり】クリングルファーマ、バイオ製薬企業への成長を視野に新オフィス開設 脊髄損傷急性期はPMDA・FDAとの協議継続
アジェンダ

安達喜一氏(以下、安達):みなさま、本日はお集まりいただき誠にありがとうございます。クリングルファーマ株式会社代表取締役社長の安達喜一です。それではこれより2025年9月期第2四半期の決算についてご報告します。
本日のアジェンダです。まず、2025年9月期上半期のトピックスについてお話しします。続いて各開発パイプラインの進捗状況として、脊髄損傷急性期、声帯瘢痕、筋萎縮性側索硬化症(ALS)の状況についてお話しします。
その後、成長戦略についてご説明し、最後に2025年9月期第2四半期の決算概況についてお話しします。その後の質疑応答を含めて、お付き合いのほどよろしくお願いします。
会社概要

当社は「難治性疾患治療薬の研究開発を行い、難病に苦しむ患者さんに対して画期的な治療手段を提供し、社会に貢献すること」を企業理念としています。現在、スライド左側に示した「再生創薬シーズHGF」という組換えタンパク質の医薬品開発に注力しています。
HGFは日本で発見された、体の中に存在するタンパク質で、誰もが体の中に持っているタンパク質です。692個のアミノ酸と、システインとシステインの間の19個の分子内架橋によって構成された、非常に複雑な立体構造をとっています。
スライド左側に2次構造を記載しています。上部のクローバーのようなかたちは「クリングル構造」というタンパク質のモチーフで、これが当社の社名の由来にもなっています。
HGF(肝細胞増殖因子)は、名前のとおり肝臓の細胞を増殖させる、肝臓の再生に関わるタンパク質として発見されました。その後の研究で、細胞を増殖させるだけではなく、細胞死を抑える、線維化を抑える、血管新生を促進するといったマルチな生物学的な機能を持つ非常にユニークなタンパク質であることがわかっています。
対象とする臓器も肝臓だけではなく、さまざまな組織・臓器の再生や修復、保護を担う、非常に重要なタンパク質であることがわかっています。体が傷を負った時に、それを治すべく体が作るタンパク質であるとご理解いただければと思います。
HGFの国際一般名称は、すでに「Oremepermin Alfa(オレメペルミン アルファ)」と決定しています。現在私たちは、このHGFの組換えタンパク質の医薬品開発を複数の対象疾患で進めている状況です。最終的に、スライド中央の写真のようなヒト用の医療用医薬品を世の中に提供し、新しい価値をみなさまに提供したいと考えています。
なお、本日最後にお話ししますが、今年4月にオフィスを移転しました。大阪の中心にある中之島の「Nakanoshima Qross」という新しい建物にオフィスを移しました。スライド右側に示したオフィスの住所も変更しています。
2025年9月期上半期のトピックス(後発事象を含む)

2025年9月期上半期のトピックスです。当社は創薬ベンチャーですが、ライセンスアウトするのではなく、国内のパイプラインについては自社で薬事承認を取る方針で進めています。
当社はレイトステージの開発パイプラインを複数持っていますが、その進捗についてご説明します。まず、第1パイプラインの脊髄損傷急性期についてです。国内では第Ⅲ相試験が終了しており、現在PMDA(医薬品医療機器総合機構)と承認申請に向けた協議を継続しています。一方、アメリカでは治験を開始するための準備を進めており、当局のFDA(アメリカ食品医薬品局)との協議を継続しているところです。こちらは後ほどお話しします。
第2パイプラインの声帯瘢痕です。現在、国内で第Ⅲ相の臨床試験を実施中です。今年1月に実施施設を2施設新たに追加し、組入れを継続しているところです。
第3パイプラインのALSは、第Ⅱ相試験まで国内で終了しています。現在、東北大学との共同研究という枠組みで追加解析を行っています。もともと2025年3月までの予定でしたが、解析作業に時間がかかっており、2025年9月まで延長するというアナウンスを今年4月に出しています。
当社は、創薬バイオベンチャーからバイオ製薬企業へと成長することを掲げています。スライド左下に、バイオ製薬企業に成長するための環境整備として2点記載しています。まず1つ目は、前回の決算説明の時にもご報告しましたが、当社が医薬品の製造販売承認申請をするにあたり、第一種医薬品製造販売業の許可を取得する必要があります。これを昨年末に申請し、今年1月に取得しています。
2つ目がオフィスの移転です。大阪の中心地にある「Nakanoshima Qross」にオフィスを移転し、茨木市彩都のオフィスよりも広くなりました。これから人員増も考えられますので、それに向けて体制の整備を進めているところです。
開発パイプラインの概要

各開発パイプラインの進捗状況です。スライドの表は、臨床段階にある4つのパイプラインの進捗状況をまとめたものです。第1パイプラインの脊髄損傷急性期は、現在PMDAと承認申請に向けた協議を継続しているところです。
第2パイプラインの声帯瘢痕は、第Ⅲ相試験を自社で実施しており、症例組入れが進行中です。第2パイプラインも、薬事承認は自社で取得する方針です。
第3パイプラインのALSは、第Ⅱ相試験を終了した後、追加解析を行っています。第3パイプラインは追加解析の結果をもって製薬企業のパートナーを得て、その後開発を進めたいと考えています。
第4パイプラインの急性腎障害はアメリカで第Ⅰ相試験が終了しており、第Ⅱ相試験を開始するためのパートナーを探索中です。
開発パイプライン-脊髄損傷急性期-

第1パイプラインの脊髄損傷急性期についてです。現在、日本では年間約6,000人の方が新たに脊髄損傷になるといわれています。転倒や事故、スポーツなどで脊髄が損傷することで脊髄損傷になるわけですが、基本的に損傷部位から下の運動神経、感覚神経が障害を受けて麻痺します。損傷部位が脳に近いほど広範な麻痺が残ります。現在、治療薬あるいは手術などによる根本的な治療法がない疾患です。
患者さまは大変つらいわけですが、周りの介護される方、ご家族の負担も非常に大きくなります。脊髄損傷の患者さまが少しでも体を動かせるような薬が実用化できれば、非常に大きな医療経済効果が見込めます。
脊髄損傷急性期にHGFに期待する治療効果
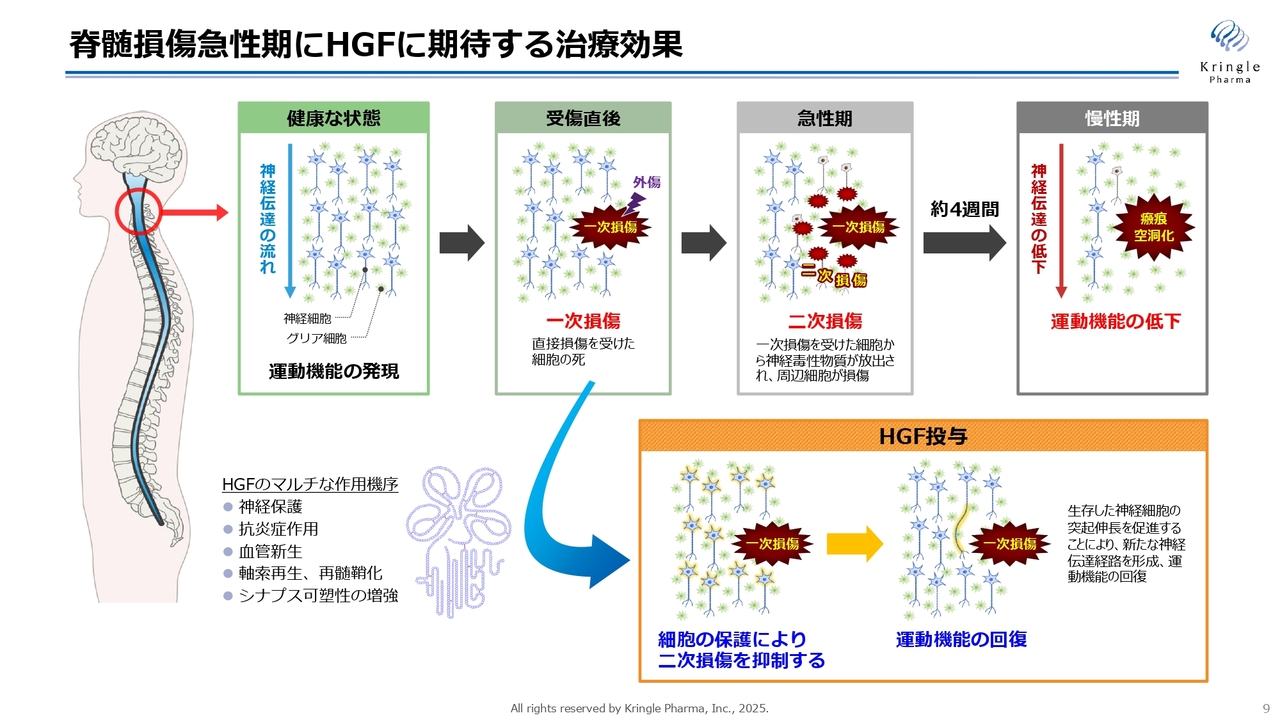
振り返りになりますが、HGFがなぜ脊髄損傷の急性期に効果があるかをスライドにまとめています。最初の脊髄損傷を一次損傷といいます。これは防ぎようがありません。受傷してから2週間から1ヶ月ぐらいの急性期において、最初の一次損傷から周りにどんどん損傷範囲が広がっていく二次損傷の拡大が起こります。
慢性期に入ると、損傷範囲が瘢痕化して空洞化してしまいます。そうすると神経の伝達が上から下に伝わらなくなり、運動機能が低下します。この急性期にHGFを投与することで、HGFのマルチな作用によって、二次損傷の拡大ができるだけ抑制されることを期待しています。
HGFは中枢神経系にも非常に強力に作用します。運動神経の細胞死を抑えて神経を保護する働きに加え、炎症反応を抑える働きもあります。脊髄損傷の急性期には、炎症反応が非常に激しく起こりますので、これを抑えることはとても重要です。
また、血管新生や軸索再生といった働きもあります。このようなマルチな働きで二次損傷をできるだけ抑えることによって、患者さまの運動機能の回復を期待しています。
脊髄損傷急性期 第III相試験(医薬品開発の最終段階)
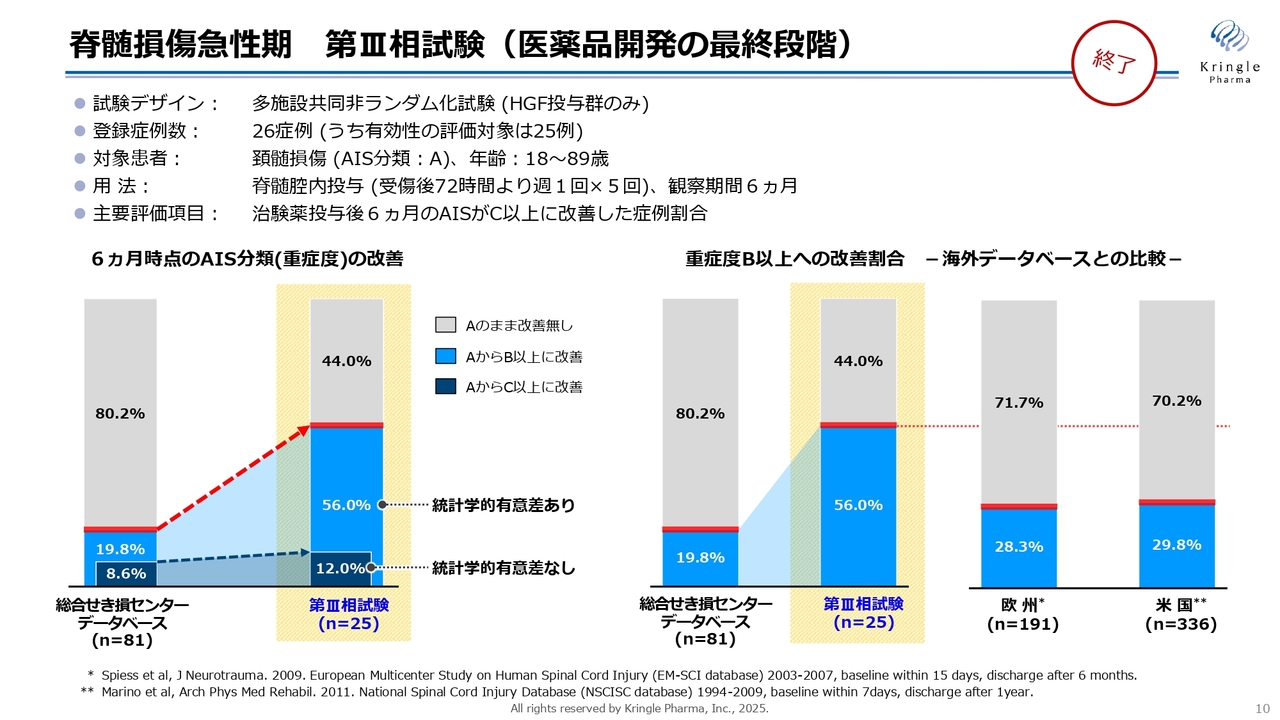
私たちは、すでに国内で第Ⅰ/Ⅱ相試験、第Ⅲ相試験の2つの臨床試験を終了しています。本日は第Ⅰ/Ⅱ相試験の結果は割愛し、その後の第Ⅲ相試験の結果についてご説明します。
第Ⅲ相試験は、多施設共同非ランダム化試験というデザインで、HGFの投与群のみからなる非常に小規模な試験デザインになっています。
何と比較するかというと、総合せき損センターという国立の脊髄損傷専門の病院がありますが、そちらに過去10年間蓄積されてきた患者さまのデータベースがあります。そこから今回の対象患者さまと同じ背景の患者さまを選び、そのデータと今回の第Ⅲ相試験のデータを比較するというデザインになっています。
対象患者さまは、頚髄損傷という首に損傷を負った患者さまです。重症度分類Aの最も重度な脊髄損傷患者さまを選んでいます。重症度Aは完全麻痺といわれており、首から下の運動機能と感覚機能がまったくない、最もシビアな患者さまになります。
用法用量は前相と同様で、初回の投与が受傷してから72時間、つまり3日目に脊髄腔内にHGFのタンパク質を投与します。その後週1回の投与を5回繰り返し、6ヶ月経過を観察します。この間は通常のリハビリテーションをみなさまに受けていただき、6ヶ月後に重症度がどのように変化したかをモニターします。
本試験の主要評価項目は、6ヶ月時点で重症度がC以上、つまりAからC以上、2段階以上改善した症例割合と設定しています。スライドの黄色い背景が今回の試験での重症度の変化の割合を示しています。
グレー色は、重症度Aの患者さまが6ヶ月後でも重症Aで変化がなかった割合です。薄い青色はAからB以上、1段階以上改善した患者さまの割合です。濃い青色はAからC以上、2段階以上改善した患者さまの割合となります。
一番左側の総合脊髄損傷センターのデータベースと比較すると、濃い青色、つまり2段階以上の改善は、数字としては8.6パーセントから12.0パーセントに増えていますが、統計学的な有意差はありませんでした。
一方で、薄い青色、つまりAからB以上、1段階以上の改善については、データベースの19.8パーセントに対して今回の試験が56パーセントと、半数以上の方が1段階以上改善しており、非常に大きな効果が認められました。
これらのデータは日本のデータになるわけですが、海外のデータと比較したものが右側のバーになります。アメリカでも欧州でもデータベースの数値が論文として発表されていますが、頚髄損傷で重症度Aの方は、アメリカでも欧州でも約7割の方が引き続き重症度Aで6ヶ月過ぎてしまっています。また、約3割の方で重症度が1段階以上改善することが報告されています。
したがって、今回の第Ⅲ相試験で半分以上の方が重症度1段階以上改善したことは、日本のデータだけではなく海外のデータと比較しても、非常に優れていると言ってよいかと思います。
急性期完全麻痺患者に対するHGFの効果
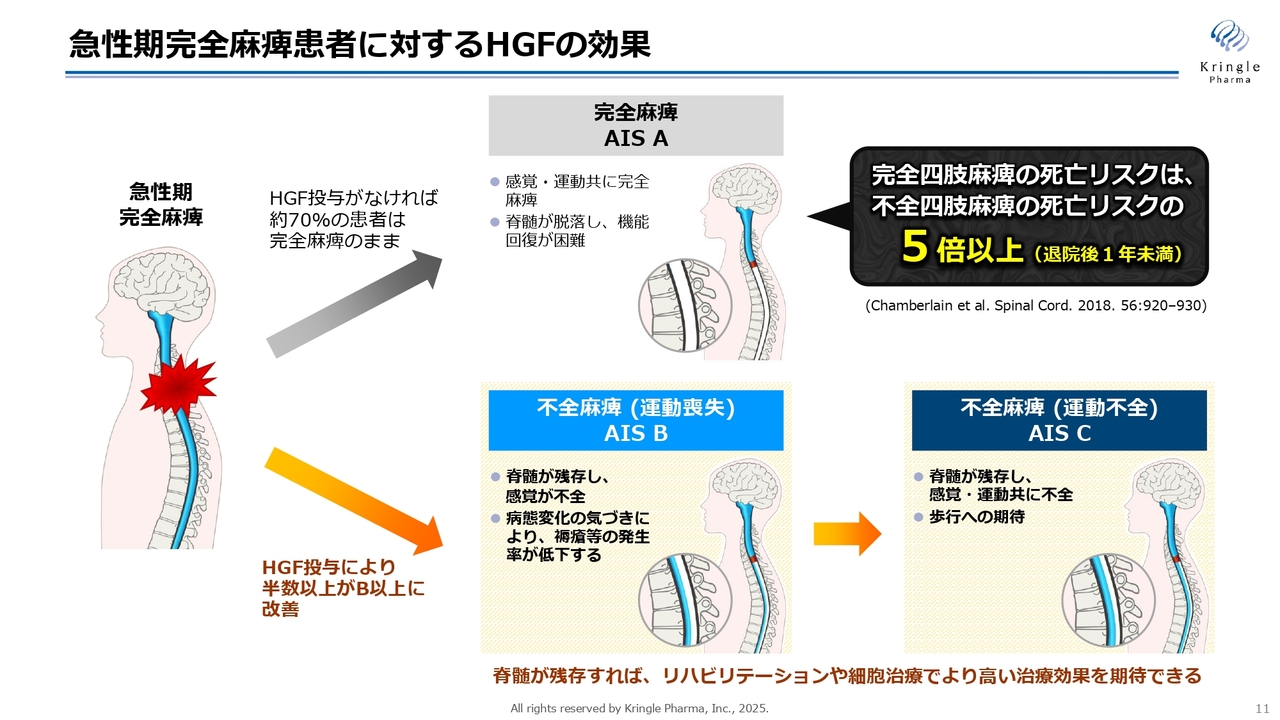
重症度が1段階改善することが、どれだけ患者さまに意味があるのかについてですが、これは実は非常に重要な意味があります。
首での脊髄損傷において、何もしないと、7割の方は慢性期にも重症度Aのまま移ってしまいます。スライドで上のほうに向いているグレー色の矢印が指す状態になってしまうわけです。慢性期で完全麻痺、重症度Aとなると、青色で示した脊髄が脱落してしまうようなかたちになり、ここからどれだけリハビリをがんばっても、ないものは回復できないため、機能回復が非常に困難になります。
一方で、重症度B以上は不全麻痺で、スライドの下のラインの状態になります。要は、その神経が残存している状態です。重症度Bの方は感覚が戻ってきますし、重症度Cの方は運動機能が戻ってきます。
神経が残存していると、リハビリや、現在開発されている細胞治療を施すことによって、さらなる効果が期待できます。そのため、急性期の治療で最も重要なことは、できるだけ多くの患者さまを完全麻痺から不全麻痺のラインに持ってくることです。
それによって、その後の治療でさらにBからC、あるいはCからDに改善する可能性が残されるわけです。いかに患者さまをこの下のラインに持ってくるかが、脊髄損傷の急性期治療で最も重要なことになります。
現在、脊髄損傷の急性期に対して、ステロイドの大量投与は薬事上認められているものの、副作用が大きく、実際の医療現場ではほとんど使われなくなってきている状況です。現場の先生方も打つ手がないという状況です。今回の治験、また前相でも同様の傾向が認められていますが、HGFを急性期に5回投与することによって、半数以上の方が不全麻痺のラインにくることがわかっていますので、医薬品として患者さまに届ける価値のある重要な意義だと考えています。
脊髄損傷急性期 承認申請に向けた準備状況

承認申請に向けた現在の状況です。まず、第Ⅲ相試験はすでに総括報告書の作成まで終了しています。PMDAとの協議について、事前面談はすでに終了しており、申請前相談のステップに入っています。
前回の決算説明でも同様でしたが、協議が継続している状態です。この後の製造販売承認申請については、具体的な時期まではまだ見通せない状況です。前回の説明時には、2025年4月以降としたのですが、すでに4月も終わっていますので、現段階では5月以降と記載しています。
申請にあたり、パッケージを作成する必要がありますが、こちらも着々と進めています。また、申請するためには第一種医薬品製造販売業許可を取得する必要がありますが、こちらについてはすでに社内の体制を整備した上で、無事に取得を完了しています。
脊髄損傷急性期 薬事承認後のサプライチェーン
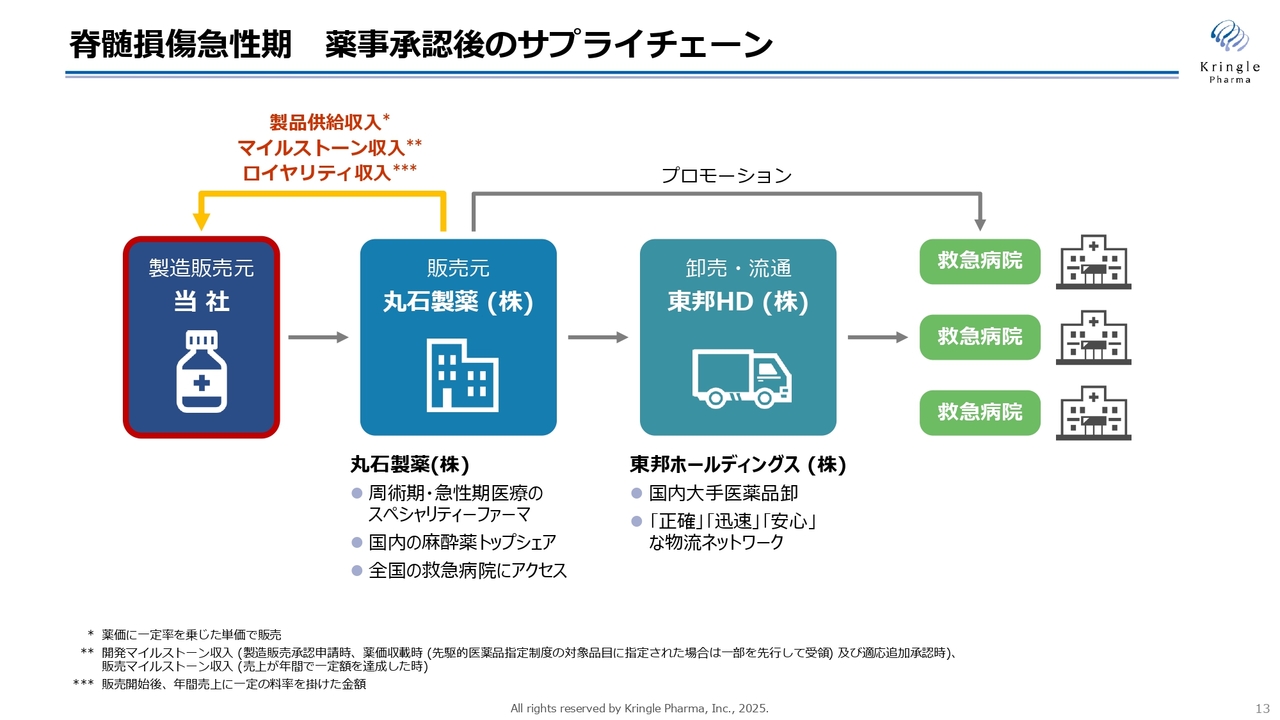
当社が承認申請を取り、製造販売元になるわけですが、「実際に薬が承認された後に、きちんと販売できるのですか?」というご質問を受けることがあります。
スライドは過去にも示していますが、当社が承認を取った後のサプライチェーンもすでに構築済みです。当社が一番左側の製造販売元となり、製品供給を販売元となる丸石製薬に対して行います。日本では、医薬品卸の会社が最終的に病院に薬を届けますが、そちらについては東邦ホールディングスとすでに契約が済んでいます。スライドのような一直線の一手販売・一手卸のサプライチェーン体制となります。
丸石製薬は急性期の医療、周術期の医療に非常に強いスペシャリティファーマで、国内の病院、手術室等で使われる麻酔薬のトップシェアを誇っています。全国の救急病院にMRが常に展開していますので、本剤をプロモーションするに最もふさわしい製薬企業であると考えています。
東邦ホールディングスも国内のいわゆる4大卸の1つで、全国の救急病院にアクセスできる体制ができています。承認が取れましたら、スライドの流れで病院に薬が届けられる体制がすでに構築されています。
ちなみに、私どもが製造販売元となりますので、スライド左上に黄色の矢印で記載しているように、私たちのリターンは製品供給収入、それから販売のマイルストーン収入、売上に対するロイヤリティ収入というかたちになります。通常の創薬ベンチャーのように、第Ⅰ相臨床試験あるいは第Ⅱ相臨床試験の後に単純にライセンスアウトするよりも、はるかに大きな対価が得られることを付け加えたいと思います。
開発パイプライン-声帯瘢痕-

第2パイプラインの声帯瘢痕についてです。声帯瘢痕は、声帯が線維化することで硬くなってしまい、声が出にくくなります。ひどくなると声が出なくなってしまう希少疾患です。
現在国内では約1万人の方が声帯瘢痕といわれています。現段階では治療薬がありませんので、潜在的な患者さまはおそらくもっといるのではないかとされています。なぜなら、多少声が出にくい状態で受診しても薬もないため、結局それを我慢してしまう患者さまもいるのではないかと考えているためです。
発声障害の患者さんの声

声帯瘢痕は命を脅かすような疾患ではありません。しかし、当たり前に出せる声が出なくなることから、患者さまのQOLを大きく損ないます。音声障害の患者さまたちの患者会がありますが、そちらと交流し、実際の患者さまとお話することで、私自身もつらい気持ちを実感できました。
スライドは、発声障害の患者さまの患者会のパンフレットから転記しています。私たちには声が出にくいことのつらさが身にしみてわからない部分がありますが、患者さま当人にとっては大きくQOLを損ないます。また、声が仕事に直結するような場合には、職を失うことにもなりかねません。声帯瘢痕の患者さまに薬を届けることは、非常に大きな社会的・医学的な意義があるといえます。
声帯瘢痕に対するHGFの作用機序
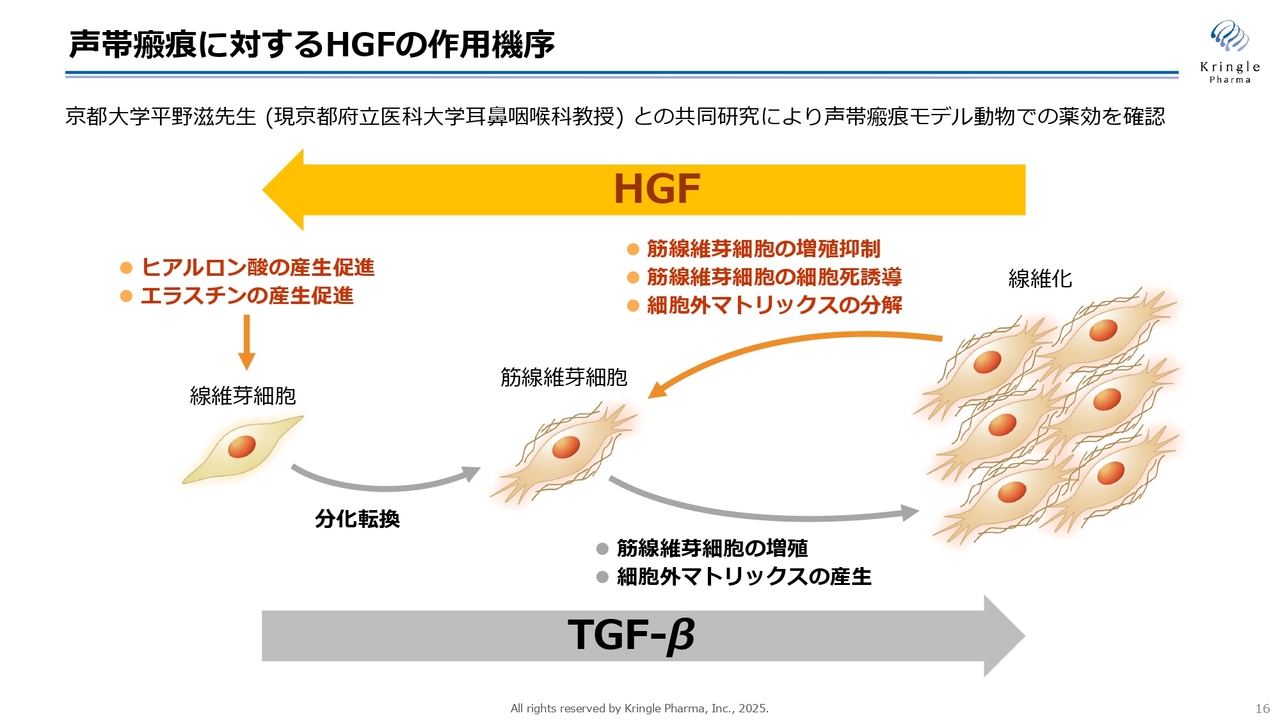
HGFがなぜ声帯瘢痕に効果があるのかというと、HGFには線維化を解除する働きがあるからです。スライドは、線維化とは何かを示しています。体の中の線維芽細胞が筋線維芽細胞という硬い細胞に分化してどんどん増えてしまい、コラーゲンなどの硬い成分を作ります。そうすると組織が硬くなってしまいます。この過程にはTGF-βという生体内のタンパク質が関与していることがわかっていますが、HGFにはこれを逆向きに進行させる作用があります。
具体的には、この筋線維芽細胞の増殖を抑制したり、細胞死を誘導したり、あるいはコラーゲンやその細胞外の硬い成分を溶かす酵素をたくさん作らせたりする働きがあります。さらに、線維芽細胞に働いてヒアルロン酸、エラスチンのような、細胞が正常に機能するために必要なやわらかい成分の産生を促進する働きによって、逆向きに線維化を解除する働きがあることが知られています。
体の中にはグロースファクター(増殖因子)は何種類かありますが、このような線維化を解除する働きは、HGFに見られる非常に特徴的でユニークな働きです。
声帯瘢痕 第I/II相試験の結果
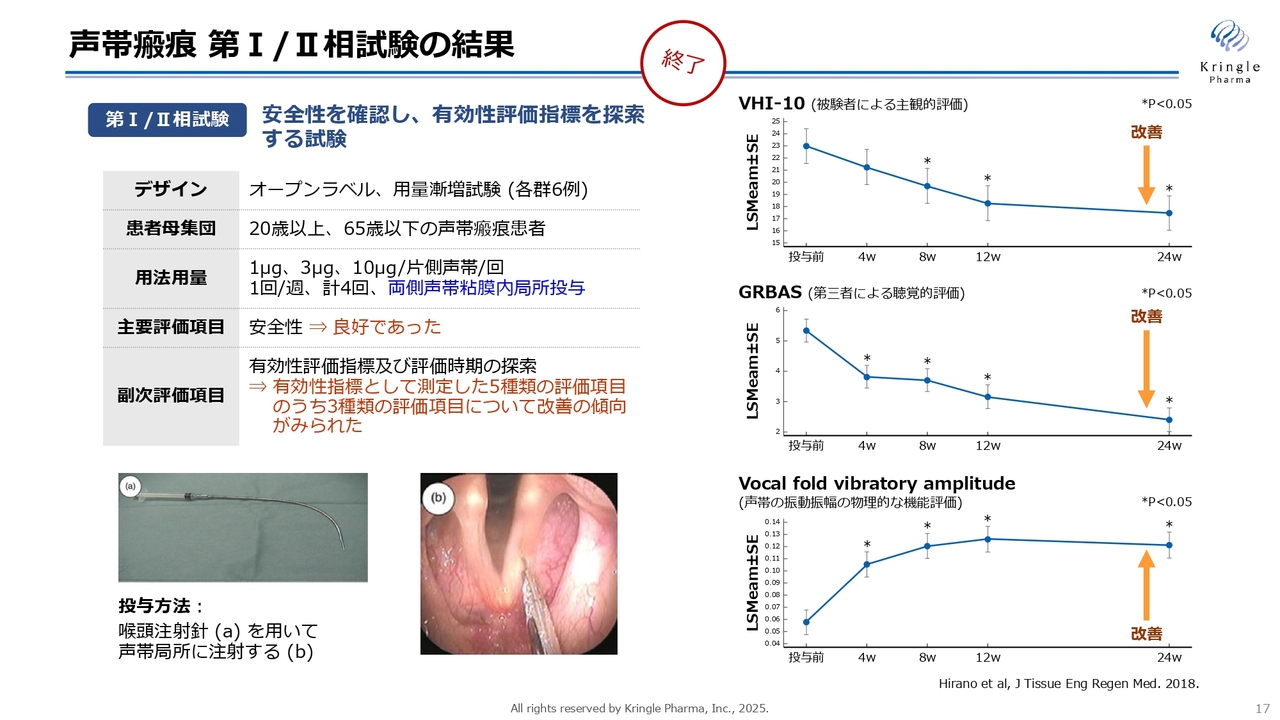
HGFを声帯瘢痕の薬にすべく、京都府立医科大学の平野先生と長年共同で開発を進めており、すでに国内で第Ⅰ/Ⅱ相試験が終了しています。スライドはHGFの低用量、中用量、高用量と3つの用量を振ったオープンラベルの試験です。一番左側の写真の注射針を用いて、右側の写真のように声帯に直接HGFを投与する方法で、週1回の投与を4回繰り返し、6ヶ月まで経過を観察するという試験です。
この試験で5種類の評価項目を調べ、このうち3種類の評価項目で改善傾向が認められました。それを示したものが右側のグラフになります。一番上の「VHI-10」は、患者さま自身の主観的な声に関する評価です。中央の「GRBAS」は、第三者が患者さまの声を聞き、その声の出方を評価したものです。一番下の「Vocal fold vibratory amplitude」は、声帯の振動振幅の物理的な機能を評価したものです。声帯の縦と横を測り、それを評価するというやり方です。
それぞれ違う視点で評価していますが、同じように改善傾向が認められましたので、HGFの効果が非常に期待できるだろうということで、現在第Ⅲ相試験に進んでいます。
声帯瘢痕 第Ⅲ相試験(医薬品開発の最終段階)

第Ⅲ相試験の概要をスライドに示しています。前相がオープンラベルの試験でしたので、第Ⅲ相試験はダブルブラインドのプラセボ比較の二重盲検試験を行っています。トータル62症例を目標に現在組入れを進めていますが、2022年から開始し、2023年に5施設で組入れ、2024年に1施設を、今年2施設を追加しています。
今年6月までに組入れを完了するとアナウンスしていましたが、5月の段階で6月に完了するのは厳しい状況になっています。追加した施設での組入れのペースが想定したペースに届いていない状況があるためです。このため、現段階では組入れの完了を6ヶ月遅くして、今年12月までと修正しました。すでに8割ぐらいの患者さまの組入れが終わっていますので、年末までには完了できると思います。
なお、最終症例の経過観察がその1年後になりますので、治験の総括報告書は2027年前半になるかと思います。
開発パイプライン-ALS-

第3パイプラインのALSについてです。神経難病の象徴的な疾患で、国内で約1万人の方がALSといわれています。原因はまだ完全にはわかっていません。既存薬はありますが、効果が限定的なため、ALSについても引き続き効果のある薬が望まれています。
ALS 第II相試験(医師主導治験)

第Ⅰ相試験、第Ⅱ相試験の2本の臨床試験がすでに終わっています。第Ⅱ相試験がダブルブラインドのプラセボ比較の試験でしたが、主要評価項目、副次項目では統計的な有意差はありませんでした。しかし、進行抑制が認められた症例もあり、現在バイオマーカーの測定を行っています。
東北大学との共同研究で患者さまの検体サンプルをすべて保管しているため、この中で神経変性、あるいは神経炎症のバイオマーカーがどのように動いて、それがHGFの投与とどのような相関があるのかを検証する試験となります。冒頭にお伝えしたとおり、共同研究を今年9月まで半年延長しました。すでに測定自体は終了し、現在は解析の段階に入っています。9月までにはデータが整うと考えています。
クリングルファーマの成長戦略
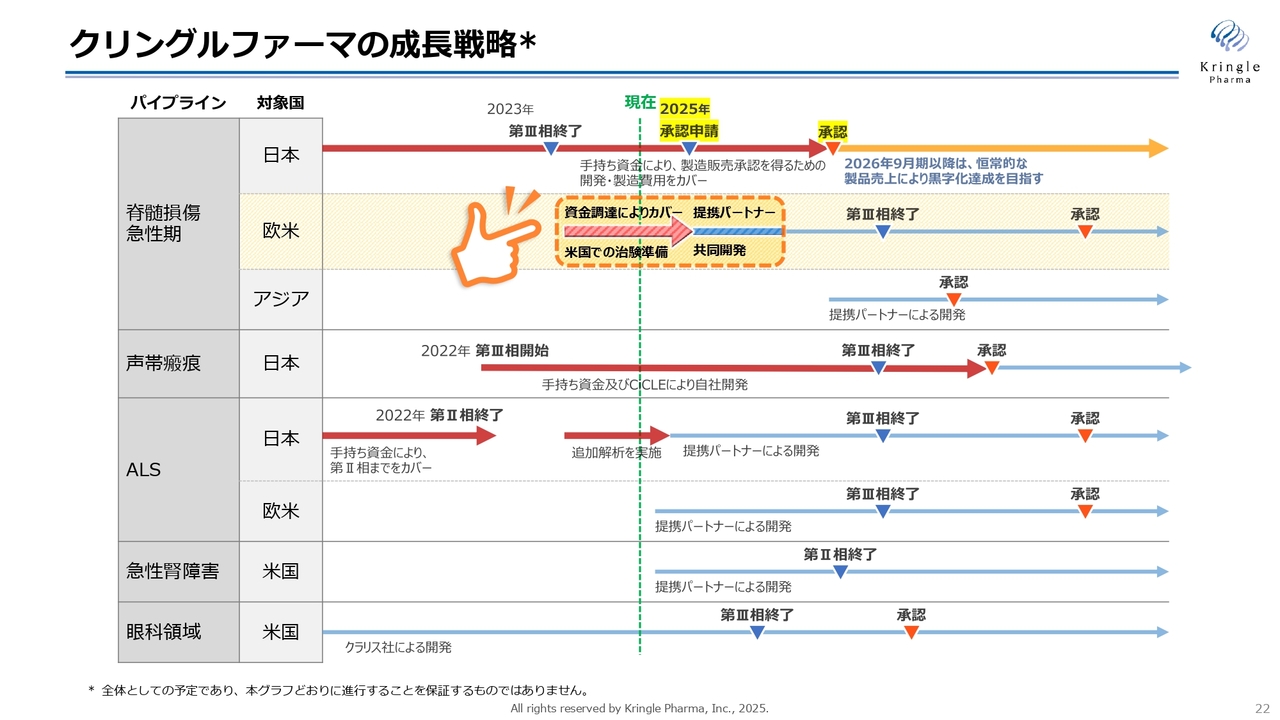
成長戦略です。スライドは毎回示しているものですが、まずは国内で脊髄損傷急性期の承認申請を行い、承認を取ることが一番重要なマイルストーンになります。PMDAとの協議は続いていますが、目標としては今期中に承認申請を行い、2026年9月期に承認を得て、製品売上を計上し黒字化を達成したいと考えています。同時並行で、欧米での開発にも着手しています。
第2パイプラインの声帯瘢痕は、第Ⅲ相試験組入れを今年年末までに完了し、自社で薬事承認を取る方針です。
ALSは追加解析を実施中です。こちらの結果をもって提携パートナーを得て、第Ⅲ相試験に進みたいと考えています。
患者数と市場規模
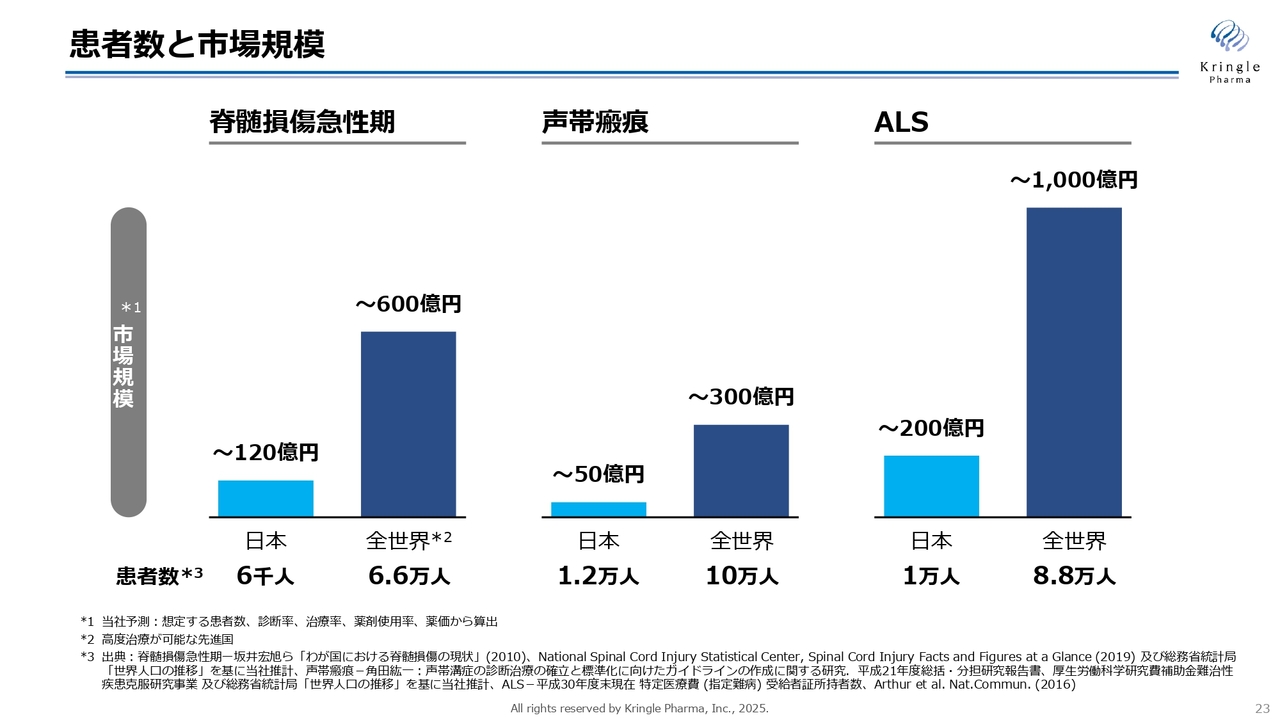
中長期の成長戦略をどのように成し遂げるかについて、ご説明します。大きく2つあります。1つ目が海外展開です。スライドは以前も示したものですが、国内とグローバルで脊髄損傷急性期や声帯瘢痕、ALSの患者さまがどのくらいいるのか、市場規模がどのくらいかを棒グラフにしています。
希少疾患で患者数は限定的なため、国内のみの市場は限定的です。一方、海外展開すると約10倍の患者さまがいて、相応する市場もあります。このため、いかに早く世界展開をしていくかが非常に重要になっていきます。
HGFは日本人だけにあるわけではなく、誰でも体内にあります。再生や修復に関わっているため、日本だけで薬になるわけではなく、世界中の難病の患者さまの薬になりうるということです。いち早く世界展開をすることが重要になるため、脊髄損傷急性期のアメリカでの開発を進めています。
新規「再生治療薬」による新規市場開拓へ ~アカデミアとの共同研究~

2つ目は適応拡大です。HGFはこれまでさまざまな基礎研究が発表されてきました。いろいろな難病に効果がある可能性が、論文として発表されています。それをいかに人の臨床段階に持っていき、実用化するかということが重要になります。このため、スライドに記載のとおり、国内のさまざまな大学の先生と共同研究を展開しています。
また、スライドには記載していませんが、HGFを当社から提供し、いろいろな試験を国内外の先生方に行っていただいています。非常に有望なデータも出つつあるため、先生方と相談しながら、臨床段階に持っていく新たなパイプラインを早期に構築できればと考えています。
再生医療 -生体の再生を支える2つのシステム-
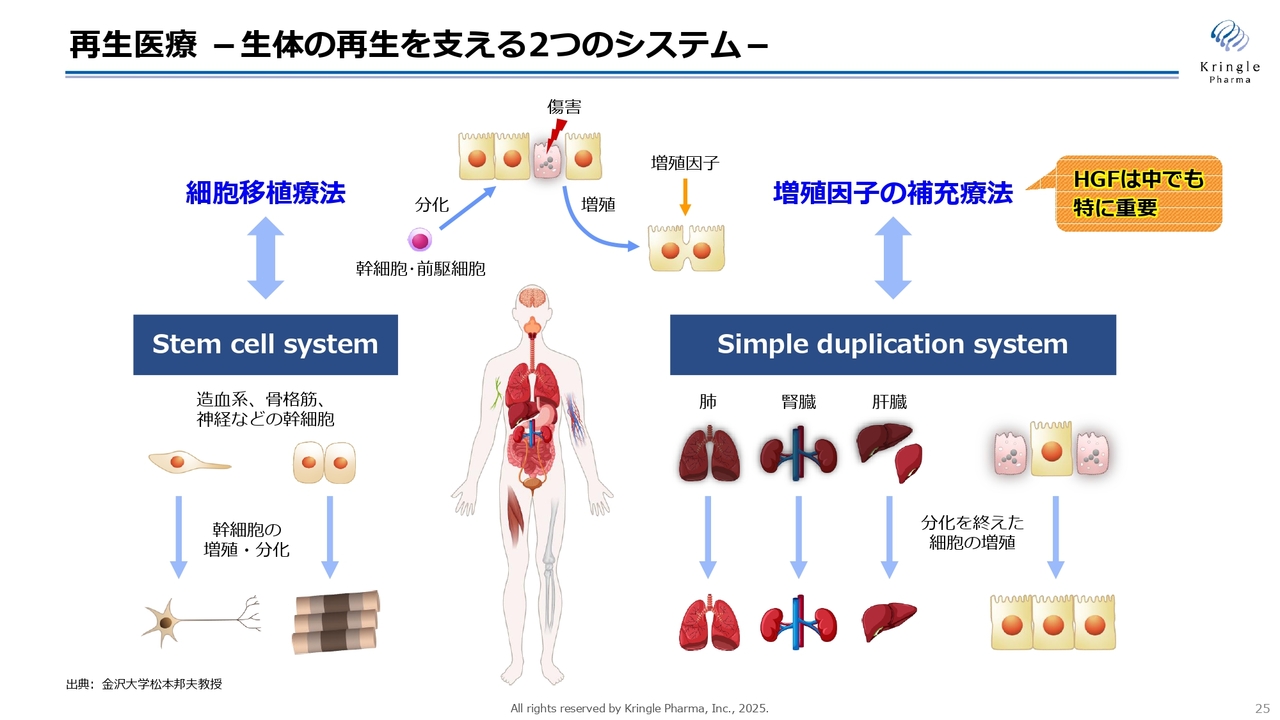
最近、iPS細胞のニュースが多数報道されています。例えば、慶応義塾大学で脊髄損傷の亜急性期に対するiPS細胞の臨床研究の結果が再生医療学会で報告され、ニュース等でも大きく報道されました。また、京都大学が行ったパーキンソン病に対するiPS治療の結果も、非常に有望だったと発表がありました。大阪大学発のバイオベンチャーで、心臓を対象にiPS細胞の治験を行い、承認申請したというニュースも出ています。このように、iPS細胞の実用化に関するニュースが続きました。
「iPS細胞が実用化されると、HGFの出番はなくなるのではないか?」といった質問がよく寄せられますが、そのようなことはありません。スライドに掲載しているとおり、生体内にはもともと再生に関わる2つのメカニズムがあります。
例えば組織・臓器が傷害を負った時には、幹細胞が新たに分化して補います。これが、スライドの左側に掲載しているStem cell systemです。こちらを医学的に応用するのが、細胞移植療法で、iPS細胞や間葉系の幹細胞を移植する方法です。
一方、傷ついた細胞の周りの細胞が増殖して補うのが、スライドの右側に掲載しているSimple duplication systemです。傷ついた臓器・組織が自ら増殖していきます。こちらに増殖因子が関わっており、中でもHGFは特に再生や修復に重要であることがわかっています。
もともと体の中には、こちらの2つのシステムが非常に良いバランスで再生や修復を担っているため、どちらか一方があればどちらか一方はいらないという話ではありません。最終的には、細胞治療と増殖因子の補充療法は、適切な対象疾患に対して適切なタイミングで両方使うことによって、さらなる効果が期待できます。
脊髄損傷急性期から慢性期への展開 -慶應義塾大学との共同研究成果-
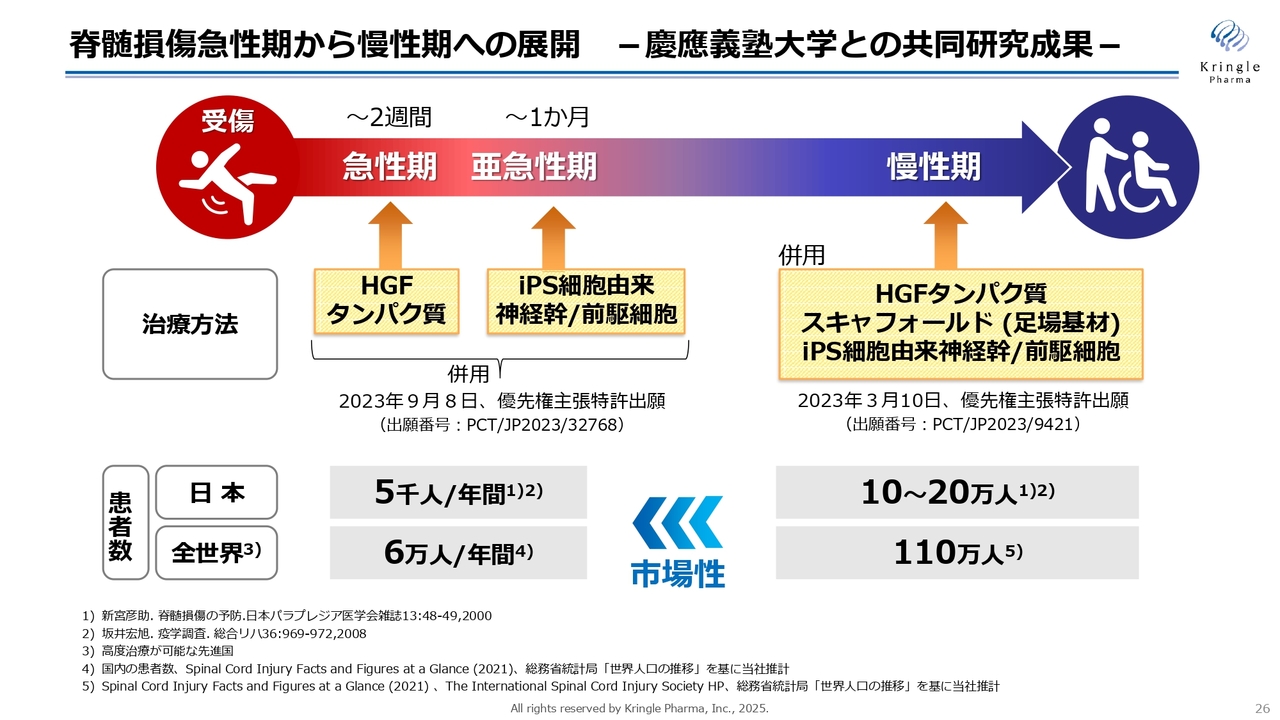
実際に、脊髄損傷では慶應義塾大学と共同研究を行い、HGFとiPS細胞由来の神経幹/前駆細胞の治療を動物モデルで組み合わせると、非常に劇的な効果が出るとわかっています。すでに論文を発表し、特許出願を行っているところです。
脊髄損傷急性期のHGF投与と亜急性期の細胞移植の併用効果
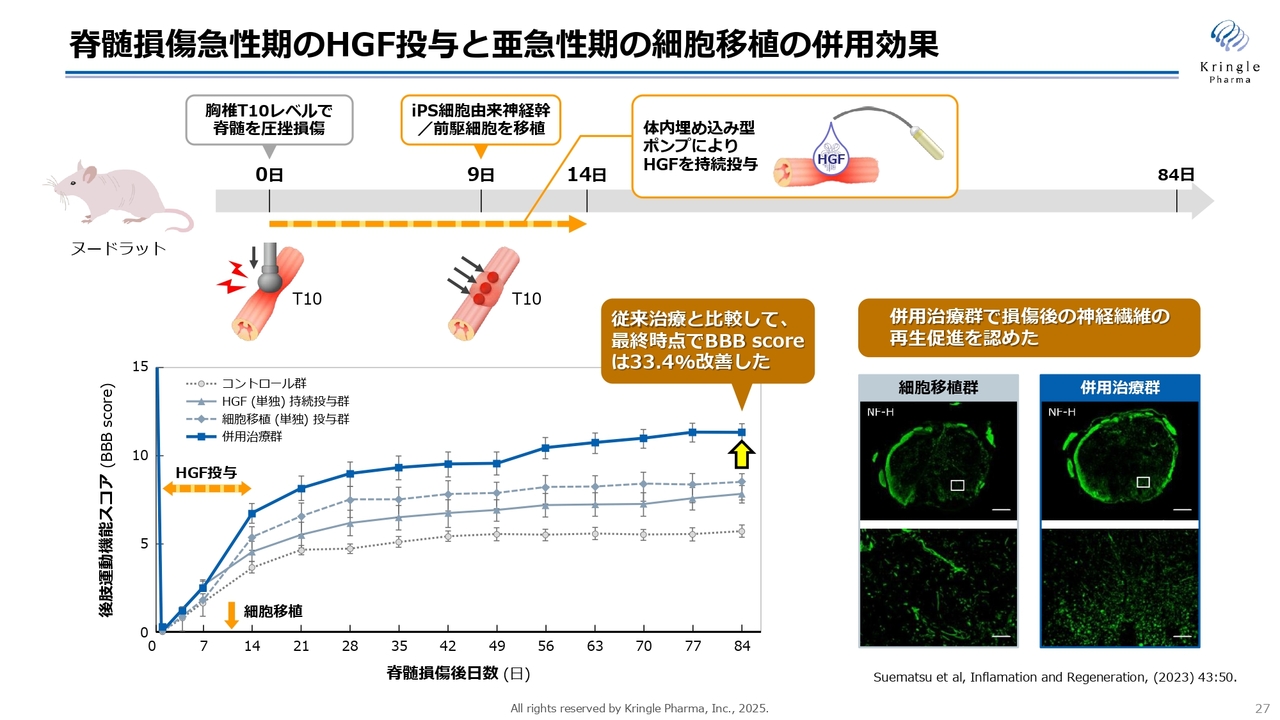
このあと実際のデータを示しますが、スライドはラットの脊髄損傷のモデルです。受傷直後からHGFを2週間ポンプで投与し、9日目にiPS細胞を移植するというモデルです。スライドの下部には、後肢の運動機能のスコアのグラフを掲載しています。
グラフの一番上の濃い青色が併用治療群です。下の破線やグレーの線はHGFの単独投与群、あるいは細胞移植の単独群です。やはり両方使ったほうが、圧倒的に改善効果が高いことがわかります。
慢性期完全脊髄損傷ラットモデルにおけるHGFと細胞移植の併用効果
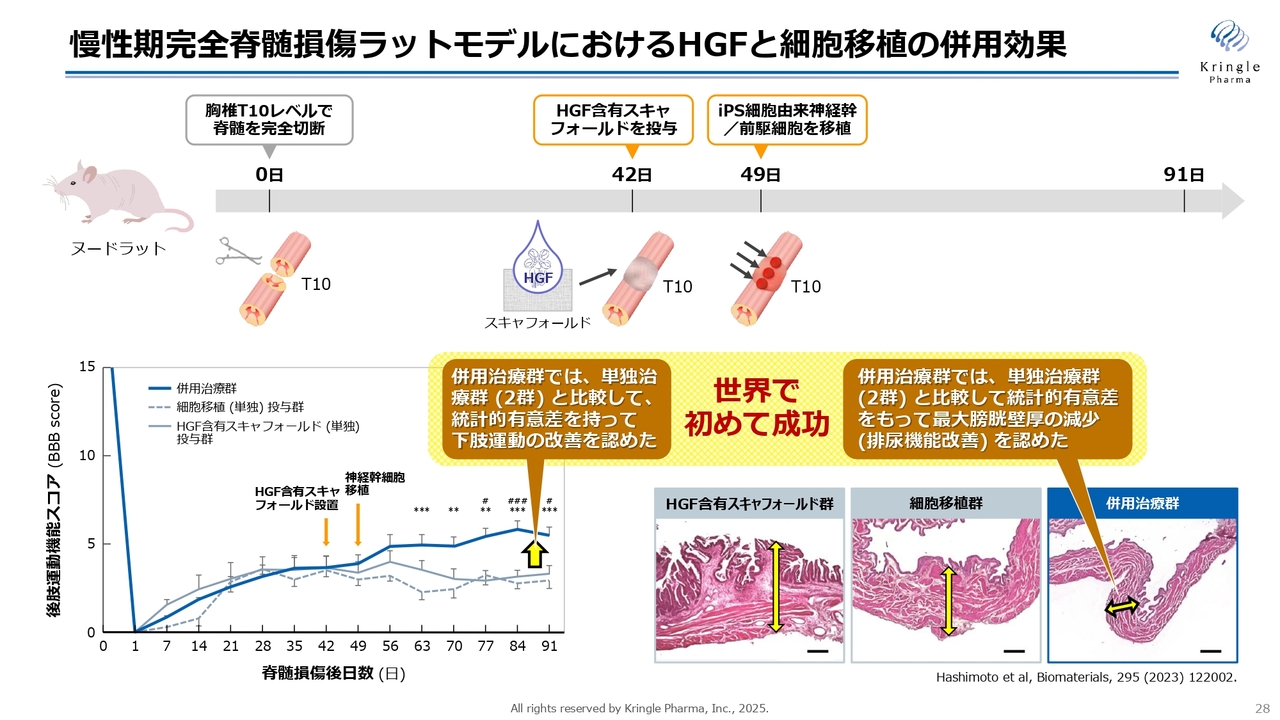
スライドは慢性期のモデルです。ラットの脊髄をはさみで切る最もシビアなモデルで、HGF単独あるいは細胞移植単独ではなかなか効果が見込めませんが、慢性期に入った42日目にHGFをスキャフォールドという足場に染み込ませて切ったところに留置をします。HGFの作用で再生しやすい環境が整えられ、1週間後にiPS細胞を移植すると、スライドの左下のグラフのとおり、単独投与群に比べて相乗効果が認められることが確認されています。
慢性期の患者さまにとって排尿機能は非常に重要ですが、ラットのモデルの膀胱壁を測ることによって、併用治療群で排尿効果の改善も統計的な有意な差を持って認められました。非常にシビアなラットの慢性期のモデルで、このようなデータは世界で初めてです。こちらも、論文発表と特許出願を済ませています。
以上のように、脊髄損傷のモデルではHGFとiPS細胞の移植は非常に相性が良く、組み合わせることでより効果が高いと動物モデルでわかってきました。ぜひ、実際の患者さまにも届けたいと考えています。特に、慢性期の脊髄損傷の患者さまにとっては非常に大きな福音になると思います。なんとか社会実装をしたいと考えています。
本日は脊髄損傷における併用についてお伝えしましたが、他の疾患もHGFと細胞移植を組み合わせることで、さらに効果が期待できる事例がこれから出てくると思います。
収益イメージ図
こちらも毎回示しているスライドです。海外市場開拓と適応拡大を同時並行で進めることで、中長期的に成長を遂げていきたいと考えています。
2025年9月期第2四半期 経営成績の概況
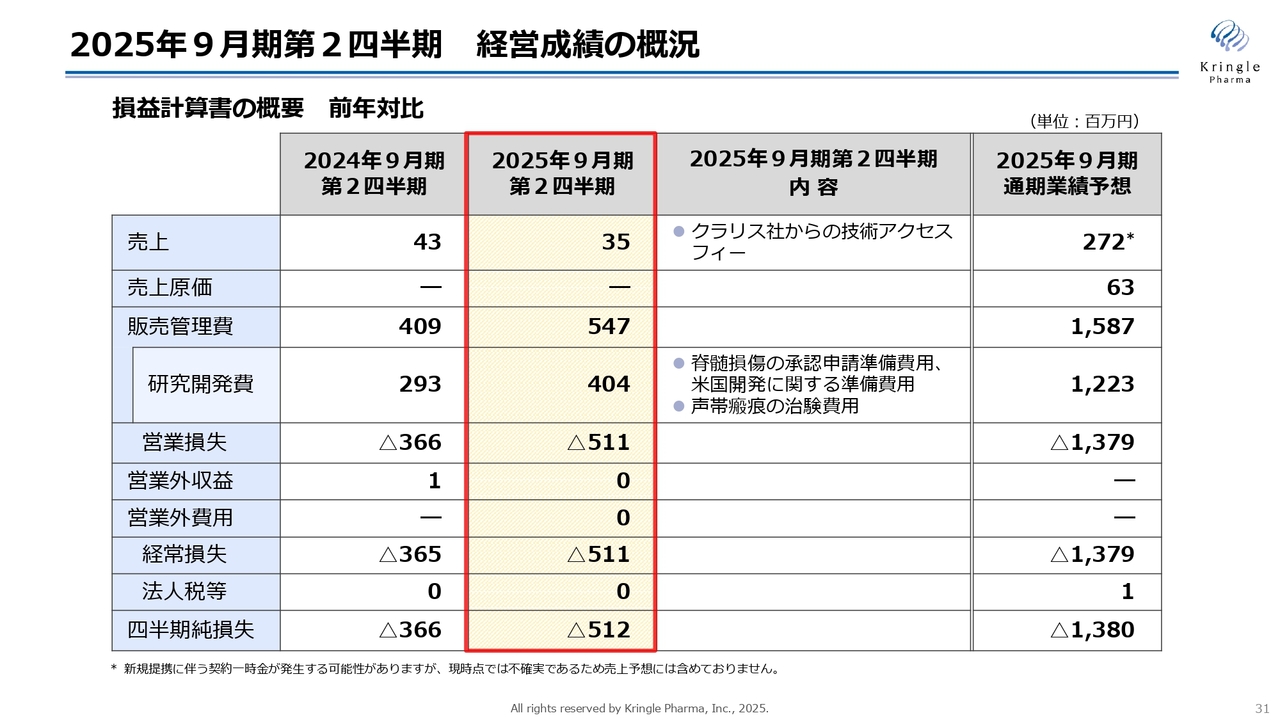
2025年9月期第2四半期の決算概況についてご説明します。経営成績の概況として、損益計算書の概要を前年比で示しています。第2四半期の売上は3,500万円でした。こちらはクラリス・バイオセラピューティクスからの技術アクセスフィーで、毎年定額でいただいています。
販売管理費は5億4,700万円、うち研究開発費が4億400万円です。脊髄損傷損傷の国内での承認申請準備やアメリカでの治験開始の準備費用、声帯瘢痕の治験費用になります。営業損失と経常損失は5億1,100万円、四半期純損失が5億1,200万円となっています。
2025年9月期第2四半期 財政状態の概況
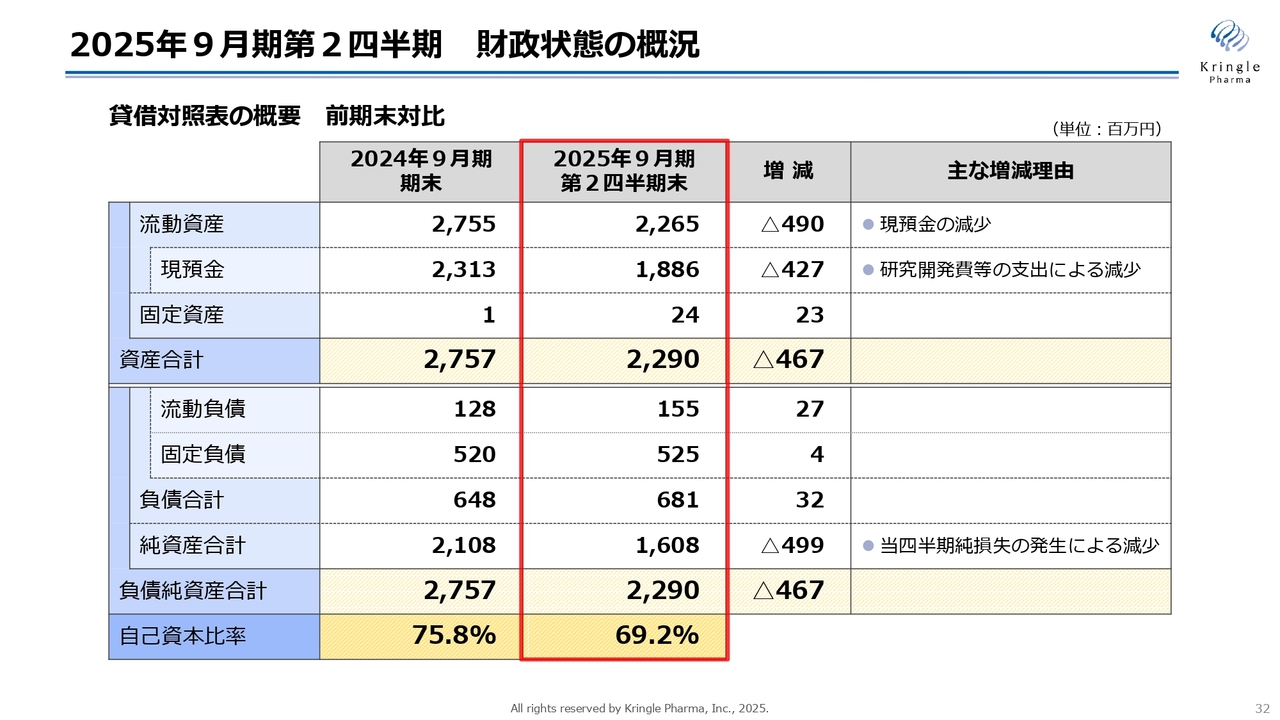
貸借対照表の概要を前期末比で示しています。流動資産は22億6,500万円でした。前期末との比較での減少は、現預金が減っている部分です。第2四半期末の現預金は18億8,600万円で、研究開発費の支出により減少しています。
固定資産2,400万円はオフィス移転に伴う敷金になります。資産合計は22億9,000万円となっています。負債は流動負債と固定負債を合わせて6億8,100万円、純資産合計は16億800万円、負債純資産合計は22億9,000万円でした。なお、自己資本比率は前期末75.8パーセントから69.2パーセントに減少していますが、引き続き健全な状態はキープしています。
2025年9月期第2四半期 キャッシュ・フローの状況
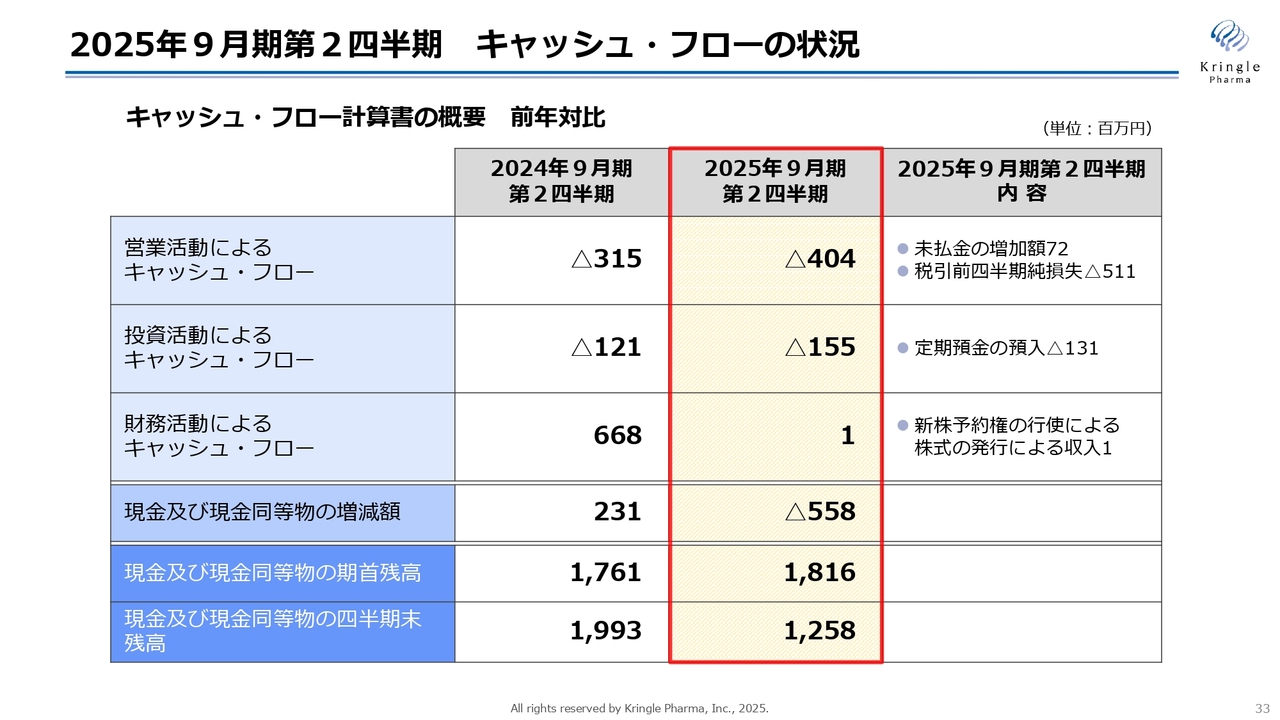
キャッシュ・フローの状況です。営業活動によるキャッシュ・フローはマイナス4億400万円です。未払金の増加額と税引前四半期純損失を合わせた額になっています。
投資活動によるキャッシュ・フローは、マイナス1億5,500万円です。主なものは声帯瘢痕のプロジェクトで、AMED(日本医療研究開発機構)からいただいている「CiCLE(医療研究開発革新基盤創成事業)」という支援制度に関するものです。こちらは、補助金と同額の担保を設定するルールになっているため、今年も発生しています。
財務活動によるキャッシュ・フローは、第2四半期は新株予約権行使の100万円のみとなっています。前期はMSワラントの資金調達で大きな数字になっていますが、当第2四半期は100万円のみです。
現金及び現金同等物の増減は前期末比マイナス5億5,800万円、現金及び現金同等物の四半期末残高は12億5,800万円となっています。
Nakanoshima Qross オフィスの開設
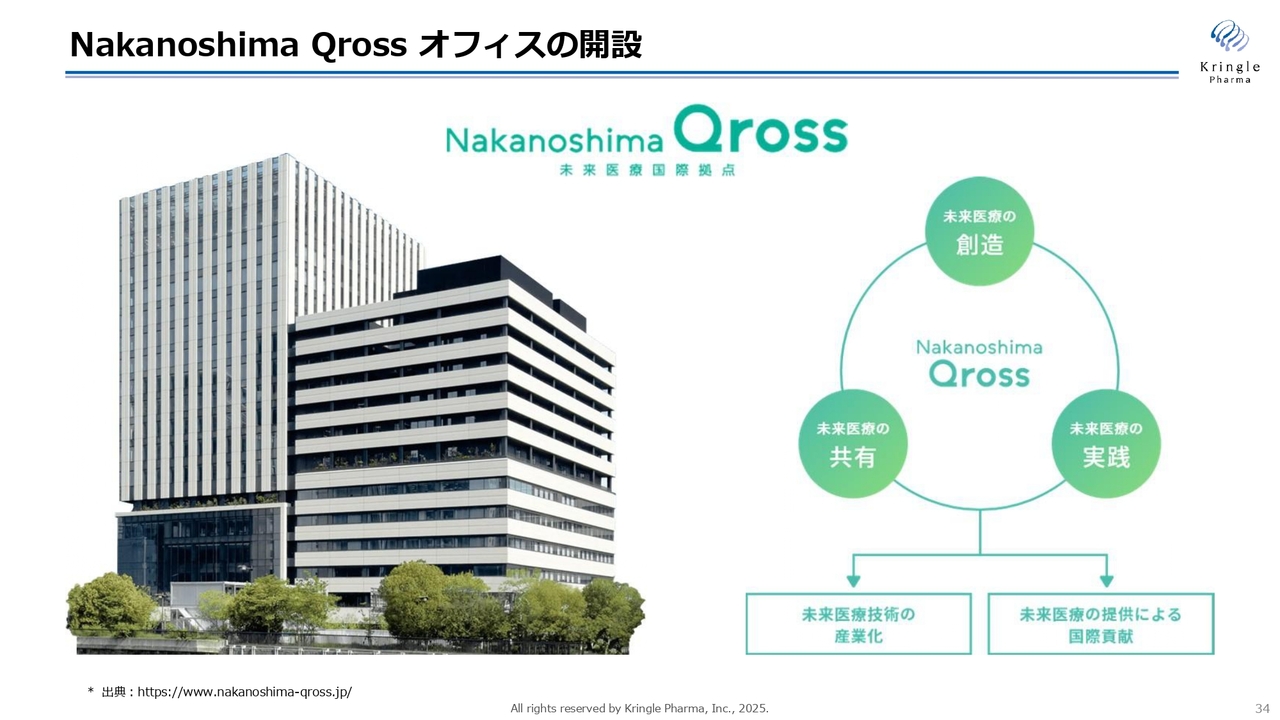
「Nakanoshima Qross」をご紹介します。当社は3月までは彩都という大阪府の北部にオフィスを構えていましたが、人員増もあり手狭になってきたため、もう少し広いスペース、かつ市内のアクセスの良いところに移ろうとオフィスを探していました。
「Nakanoshima Qross」は、かつて大阪大学医学部があった中之島に昨年竣工した新しい施設です。未来の医療の国際拠点を作るということで、再生医療に関係する製薬企業やバイオベンチャー、医療機器、AIの会社などが、スライドの画像の左側にあるオフィス棟にすでにたくさん入っています。PMDAの関西支部も、こちらに入っています。
右側は病院になっています。細胞を使った再生医療等は左側のオフィス棟で研究開発をして、右側の病院ですぐに実装・直結することで、シナジーを生もうとしています。関西地方のこれからの先端医療の中心地となり、国際拠点になるべく作られた施設です。
当社が製薬企業に成長していく場として、非常にふさわしい環境であると考え、こちらにオフィスを移しました。
クリングルファーマのビジョン
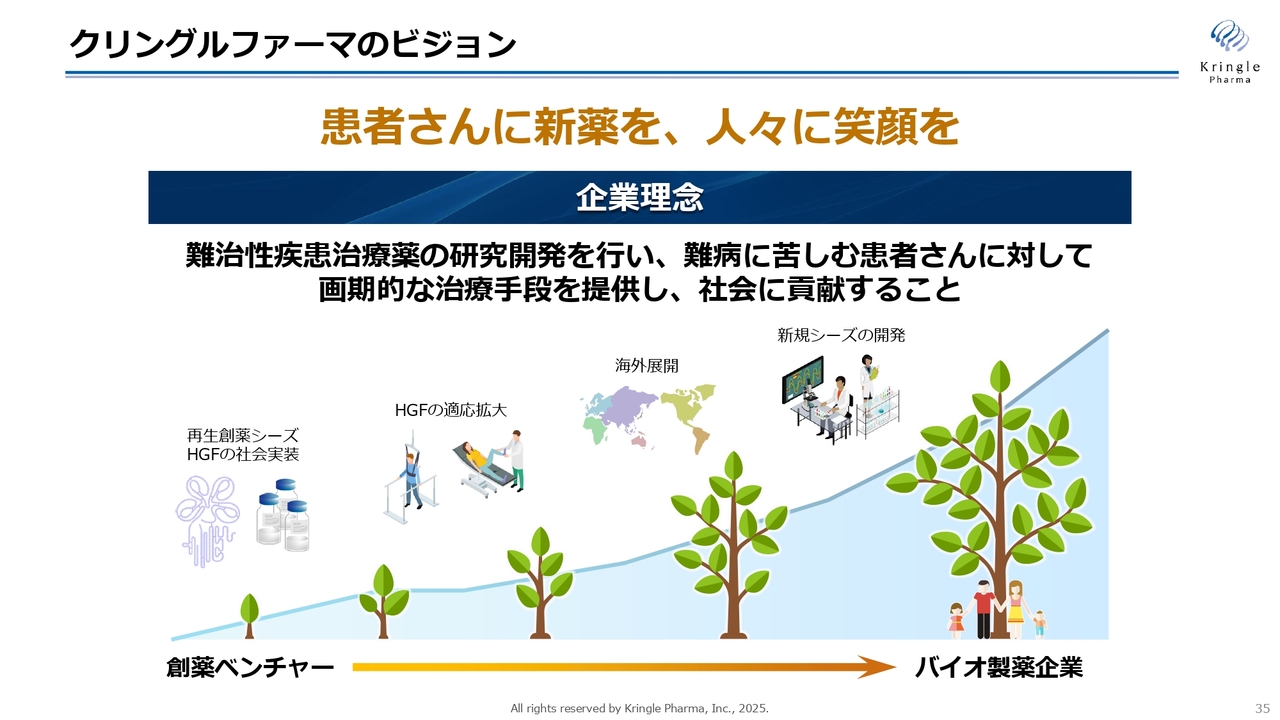
私たちは創薬バイオベンチャーで終わることはまったく考えていません。自社で製品を持って、バイオ製薬企業へと成長していく未来を考えています。そのために、まずはHGFを脊髄損傷で社会実装し、海外展開、適応拡大、最終的には日本発の新規シーズを開発し、世の中に新しい価値を提供していきたいと考えています。
質疑応答:脊髄損傷急性期の国内の承認申請状況について

司会者:「脊髄損傷急性期の国内での承認申請状況はいかがでしょうか? 前回の決算説明では、申請時期が2025年4月以降になるとのことでしたが、状況に変化はありますか?」というご質問です。
安達:先ほどご説明したとおり、まだPMDAとの協議が継続しています。協議内容を細かく開示することはできないため、具体的に合意形成ができてから開示することになります。
2月にご説明した状況から、決定事項として大きな変化はありません。承認申請の時期は、明確な見通しは現時点で立っていない状況です。
しかし、協議は継続しており、すでに次回の協議の資料作成等も順調に進めています。日程調整等で少し時間がかかった部分はありますが、今後さらに協議を進め、進展があれば速やかに開示したいと考えています。いましばらくお待ちください。
質疑応答:アメリカでの脊髄損傷急性期の開発状況について
司会者:「アメリカでの脊髄損傷急性期の開発状況について教えてください」というご質問です。
安達:先ほどお伝えしたとおり、当社にとって海外展開は、中長期での成長において欠かせないことです。まずは脊髄損傷急性期をアメリカで開発し、アメリカで承認を得るため、引き続き治験の開始に向けて準備を進めています。
アメリカのキーオピニオンリーダーといわれる専門医の先生方とのネットワークは、すでに作っています。治験のデザインについて協議を進めており、コンサルタントも活用して、FDAとの対話も継続して行っているところです。
加えて、北米の脊髄損傷のコンソーシアムと連携して、実際の患者さまへインタビューも行っています。FDAでは、Patient-focused drug developmentという日本ではあまり馴染みのない、患者さまの目線、患者さま中心での医薬品開発を推奨しています。患者さまの意見を開発段階から積極的に取り入れ、患者さまのベネフィットになる医薬品を開発することを明確に掲げています。
関連するガイダンスも出されていますので、ガイダンスに沿って患者さまへのインタビューを行い、得られた情報をこれから行う治験のデザインに反映する計画で進めています。
質疑応答:声帯瘢痕第Ⅲ相臨床試験の進捗状況および今後の見通しについて

司会者:「声帯瘢痕第Ⅲ相臨床試験の進捗状況及び今後の見通しはどのようになっていますか? 前回の決算説明では、2025年6月までに症例組入れ完了を目指すということでしたが、組入れ状況はいかがでしょうか?」というご質問です。
安達:今年1月に2施設を追加し組入れを加速して、今年6月までに完了すべく努力していましたが、新しい施設での患者さまの組入れペースが当初想定していたよりも少し遅れています。今の段階では、6月に完了するのは現実的に厳しい状況です。
このため、組入れの終了予定時期を今年12月までと修正しました。組入れ状況は、すでに約8割まで進捗しています。現在の8施設で、保守的なペースで考えても年末までには組入れが終わると思います。ペースが上がれば、12月よりも前倒しで完了できると思います。引き続き努力していきたいと思っています。
質疑応答:ALS第Ⅱ相臨床試験の追加解析の進捗について

司会者:「ALS第Ⅱ相臨床試験の追加解析は6ヶ月延長し、2025年9月末までになるという開示でしたが、順調に進んでいるのでしょうか?」というご質問です。
安達:こちらもすでに、バイオマーカーの測定自体は終了しています。現在は東北大学でデータ解析に入っているため、今年9月までには解析を完了できると考えています。解析結果の開示は、学会あるいは論文発表のタイミング等もあるため、東北大学の先生方と協議をしながら検討していく予定です。
質疑応答:クラリス・バイオセラピューティクスの開発状況について
司会者:「協業先であるクラリス・バイオセラピューティクスが実施している眼科領域の開発状況はどのようになっていますか?」というご質問です。
安達:本日はクラリス・バイオセラピューティクスに関するスライドを用意していませんが、協業を継続しています。組換えHGFタンパク質を当社から供給し、クラリス・バイオセラピューティクスがアメリカにおいて眼科領域で臨床試験を行っている状況です。
クラリス・バイオセラピューティクスは、これまで神経栄養性角膜炎という角膜の希少疾患を対象に治験を行ってきましたが、さらに対象を広げて、角膜上皮幹細胞疲弊症及び角膜瘢痕の臨床試験も実施しています。
治験の結果は、現時点ではクラリス・バイオセラピューティクスから発表がない状況です。当社はクラリス・バイオセラピューティクスとの守秘義務があるため、当社から一方的に開示することはできないとご理解ください。
クラリス・バイオセラピューティクスの治験は、アメリカの臨床試験のデータベース「ClinicalTrials.gov」で検索できます。こちらの情報として、先ほどお伝えした神経栄養性角膜炎と角膜上皮幹細胞疲弊症、角膜瘢痕に対する治験の3件が登録されています。
クラリス・バイオセラピューティクスから正式な発表がありましたら、日本語で要約するかたちでご紹介したいと考えていますので、クラリス・バイオセラピューティクスの発表をお持ちください。
質疑応答:新規パイプラインの開発状況について

司会者:「既存の4つの臨床パイプライン以外の新規パイプラインの開発状況について教えてください」というご質問です。
安達:現在、HGFタンパク質の資料提供や共同研究を通じて、スライドに掲載したもの以外にも、国内外の大学や研究機関との新たなパイプライン開発に向けた研究活動を10数件行っています。
具体的に臨床試験の開始の目途が立っている案件はありませんが、非常に有望な基礎的なデータも出てきています。近い将来には、新たな臨床パイプラインとして提示できると考えています。
質疑応答:承認申請の遅れにともなう資金調達について

司会者:「担保提供している現預金を除くと、手元の現預金は10数億円となってきていると思います。このまま脊髄損傷急性期の国内での承認申請が遅れていくと、申請に伴うマイルストーン収入も遅れるため、資金の手当が必要になってくると思われますが、いかがでしょうか?」というご質問です。
安達:既存のパイプラインである国内の脊髄損傷急性期や声帯瘢痕については、承認申請取得までの開発費の手当がすでにできています。収入はご指摘のとおり未確定な状況です。
パートナリングでの収入という可能性もありますが、こちらも未確定のため、パイプラインの今後の開発状況や承認申請、薬事承認後の状況によっては、新たな資金調達の必要性が高まってくる可能性もあると考えています。資金調達についても、事業環境の変化に応じて臨機応変に対応できるようにしていきたいと考えています。
質疑応答:髄腔内投与が可能な施設について
司会者:「上市後の広がりを考えた時、脊髄腔内投与の手技ができる病院に限られると思いますが、民間の病院では難しい気がします。臨床試験第Ⅲ相を実施した専門施設と同程度の設備を有する病院となると、大学病院などに狭まるという理解でよろしいでしょうか? 神経突起の伸長もありますが、軸索伸長も大事になるため、説明を補足いただけますか?」というご質問です。
安達:脊髄損傷の方が最初に運ばれる施設は、二次救急や三次救急という救急病院になると思います。こうした救急病院の救急科の先生や整形外科の先生にとっては、脊髄腔内に薬剤を投与することはそれほど難しい手技ではありません。二次救急や三次救急の病院であれば、脊髄腔内投与ができる体制に問題はないと考えています。
なお、ご指摘のとおり、HGFには軸索伸長だけではなく神経突起の伸長作用もあります。
質疑応答:ALSの治験について

司会者:「ALSの治験について質問です。患者のゲノム解析や原因遺伝子の特定は進んでいますか? SOD1遺伝子以外にもさまざまなドライバー遺伝子があり、非常に効果がある変異とあまり効果が出ない変異があると思います。そのような遺伝子変異に着目した効果の解析が進むことを望んでいます」というご質問です。
安達:ALSは孤発性の患者さまが大多数で多く、まだ完全には発生原因がわかっていません。一方、遺伝的なALSについても、SOD1遺伝子以外にもさまざまな遺伝子変異のALSが報告されています。
SOD1遺伝子変異のALSをターゲットにした薬は、アメリカのバイオジェン社によって実用化されています。同様に、ある特定の遺伝子変異のALSをターゲットにした薬の開発も行われています。そのような薬は、ごく一部の患者さまのみに使われることになりますが、全員が使える薬が望ましいと思っています。
HGFはどのような遺伝子変異でも、病気が起こり、運動神経がどんどん死んでいくことを抑えます。どのような原因であっても、一番下流を防ぐことができれば、ALS全体に効果があるのではないかと考えています。
この銘柄の最新ニュース
クリングルのニュース一覧- 「2026年9月期 第1四半期決算説明」の動画に関するログミーFinance書き起こし記事公開のお知らせ 2026/02/16
- クリングルファーマ、米国子会社Kringle Pharma USAを起点にIND準備を加速 脊髄損傷急性期で海外市場へリーチ 2026/02/16
- 個人投資家向けIRセミナー【バイオ IR Day 】に 当社代表取締役社長 安達喜一が登壇します 2026/02/12
- 新興市場銘柄ダイジェスト:リンクバルが急騰、ブロードエンタープライズがストップ高 2026/02/10
- 決算プラス・インパクト銘柄 【東証スタンダード・グロース】引け後 … 京都友禅HD、石川製、上村工 (2月9日発表分) 2026/02/10
マーケットニュース
おすすめ条件でスクリーニング
クリングルファーマの取引履歴を振り返りませんか?
クリングルファーマの株を取引したことがありますか?みんかぶアセットプランナーに取引口座を連携すると売買履歴をチャート上にプロットし、自分の取引を視覚的に確認することができます。
アセットプランナーの取引履歴機能とは
※アセプラを初めてご利用の場合は会員登録からお手続き下さい。










