オンコリスバイオファーマ、国内承認申請に向けて年内にテロメライシン販売提携の契約締結を目指す
目次

浦田泰生氏(以下、浦田):オンコリスバイオファーマ株式会社の2022年12月期決算説明会を行います。
2022年度の業績と2023年度の見通しについて吉村取締役からご報告し、その後、私から当社開発パイプラインである「テロメライシン」ならびに「OBP-601」、その他のパイプラインの現状と見通しについてお話しします。
2022年経営成績の概要
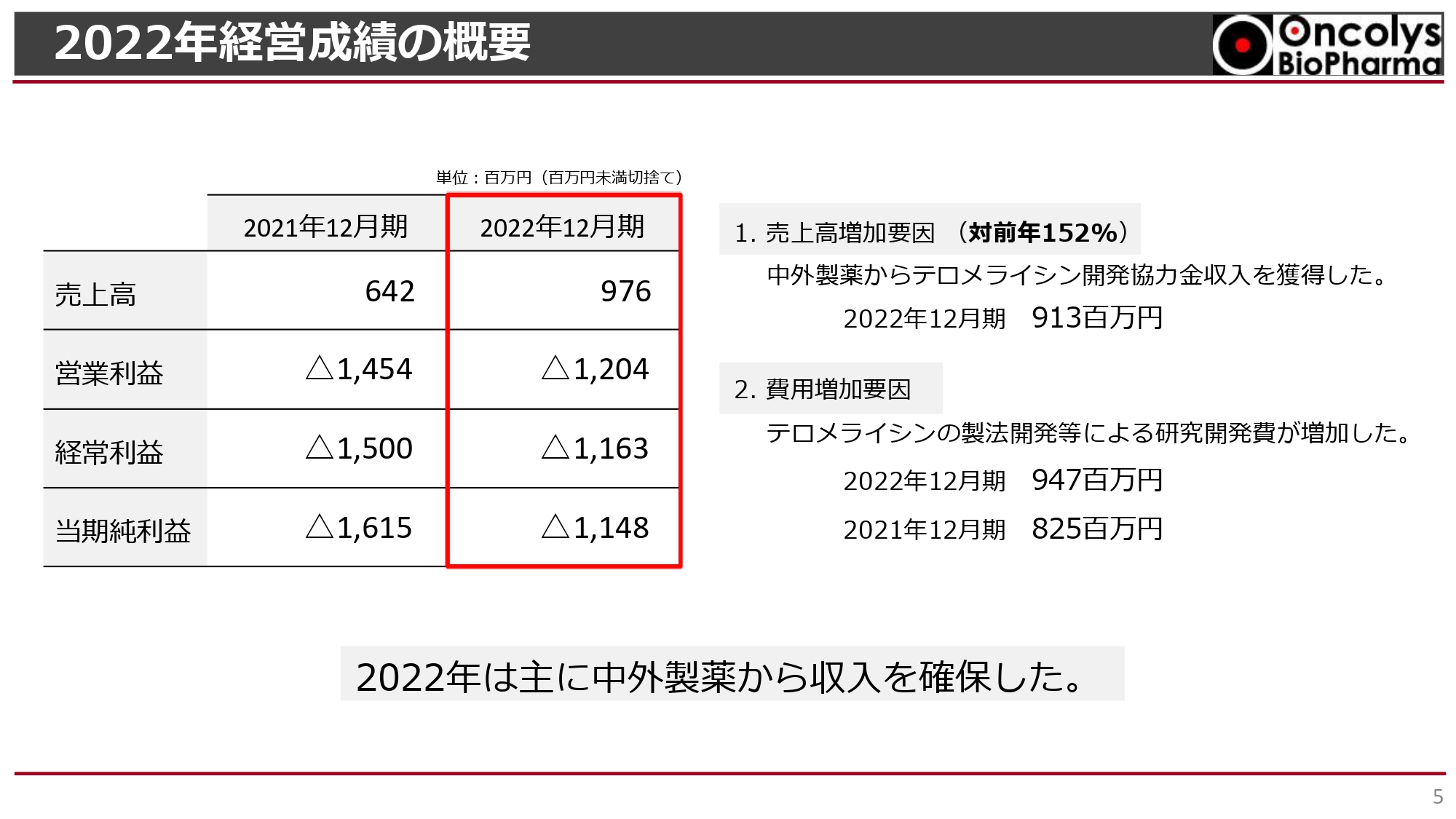
吉村圭司氏(以下、吉村):売上高は、2021年12月期が6億4,200万円、2022年12月期が9億7,600万円で、対前年比152パーセントとなりました。売上高のほとんどが中外製薬からの「テロメライシン」の開発協力金です。
営業利益は2021年12月期のマイナス14億5,400万円から、2022年12月期はマイナス12億400万円となり、2億5,000万円ほど改善しました。費用増加要因は「テロメライシン」の製法開発等による研究開発費が増加したことです。
2022年財政状態の概要
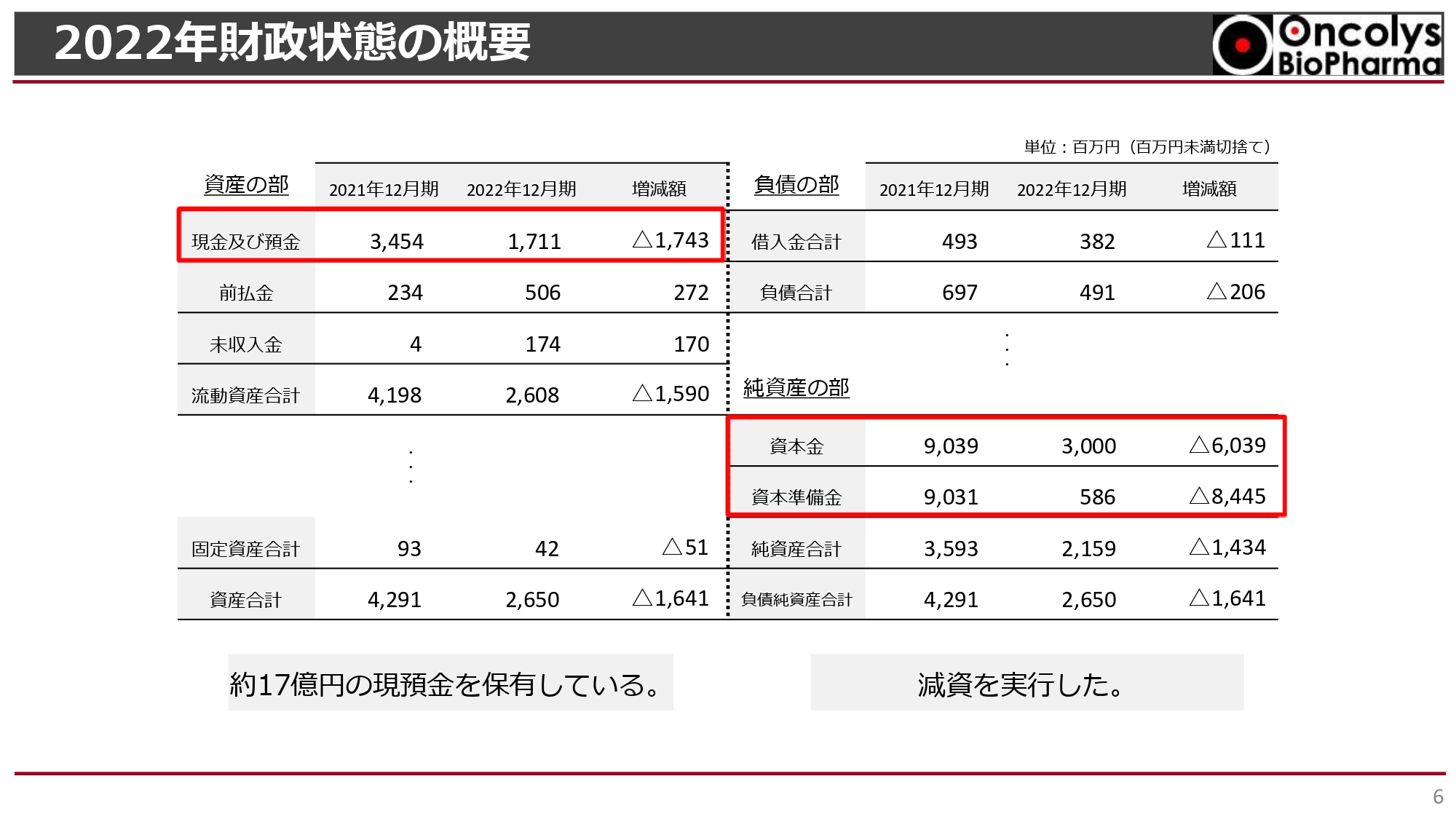
財政状態の概要です。2022年度末において17億円以上の現預金残高を保持しています。また、昨年度の株主総会で承認を得た約144億円の減資を実行しました。
2022年12月末の資本構成
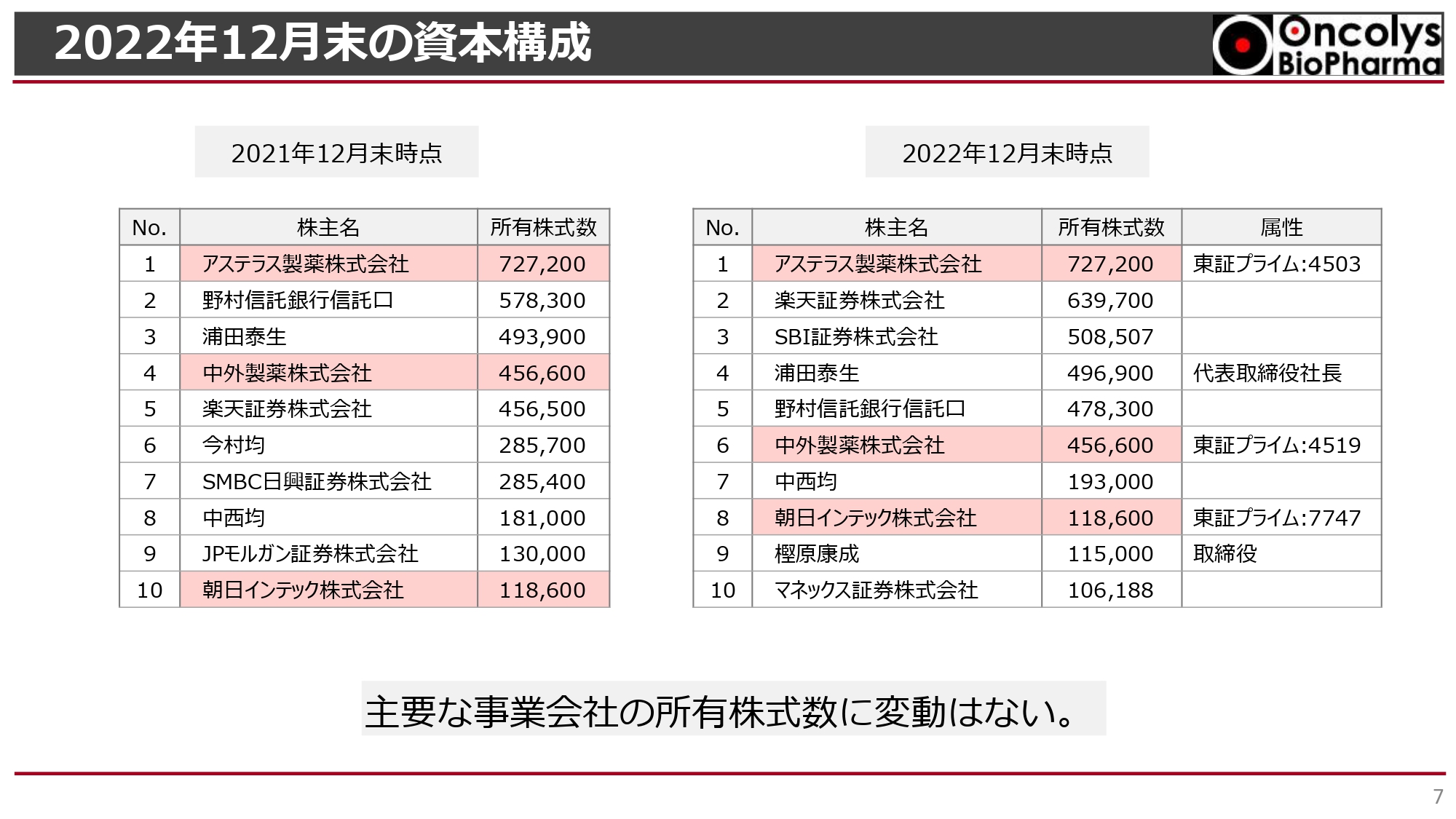
2022年度12月末の資本構成です。主要な事業会社の株主であるアステラス製薬、中外製薬、朝日インテックの所有株式数に変動はありません。発行済株式数は2021年度12月末と変わらず約1,700万株のため、事業会社の占める構成割合もほとんど変わっていない状況です。
2023年の業績見通し

2023年度の業績見通しは、すでに決算短信等で発表したように、当期の業績に与える未確定要素があるため開示を控えます。
理由としては、今期に我々が計画する新たな国内の販売提携契約の収入が未定であること、それを開示することによる経済条件交渉が不利になることを避けるためです。また、ライセンス契約締結先のイベント達成により発生するマイルストーン収入も未確定なところがあります。さらに、免疫チェックポイント阻害剤を販売する大手製薬会社との共同研究も控えており、そのための条件交渉にも差しさわると判断しました。
当社は年次での業績管理を行っているため、中間業績予想についても同じく開示を控えます。
ガバナンス体制

浦田:ガバナンス体制です。現在取締役は4名で、私と吉村取締役が財務、経理、事業管理、リスク管理などを担当しています。樫原取締役はウイルス製造などのCMC企画、海外渉外を担当しています。
社外取締役の斎藤取締役は日本たばこ産業(JT)の中国支社長などを歴任しており、当社取締役会へのサポートのみならず、さまざまなサジェスチョンをいただいています。また、Oncolys USA社長のTalia Biranは海外のビジネス開発を担当しています。
執行役員は5名です。吹野執行役員は医師であり、研究開発すべてを担当しています。秦執行役員は事業企画、磯山執行役員は事業開発、田口執行役員は人事、人事戦略を担当しています。今年から加入した米尾執行役員は、経理・財務を担当しています。
監査役会はこれまでどおり立谷常勤監査役、大木社外監査役、弁護士の永塚社外監査役で構成しています。
マネジメントのスキルセット
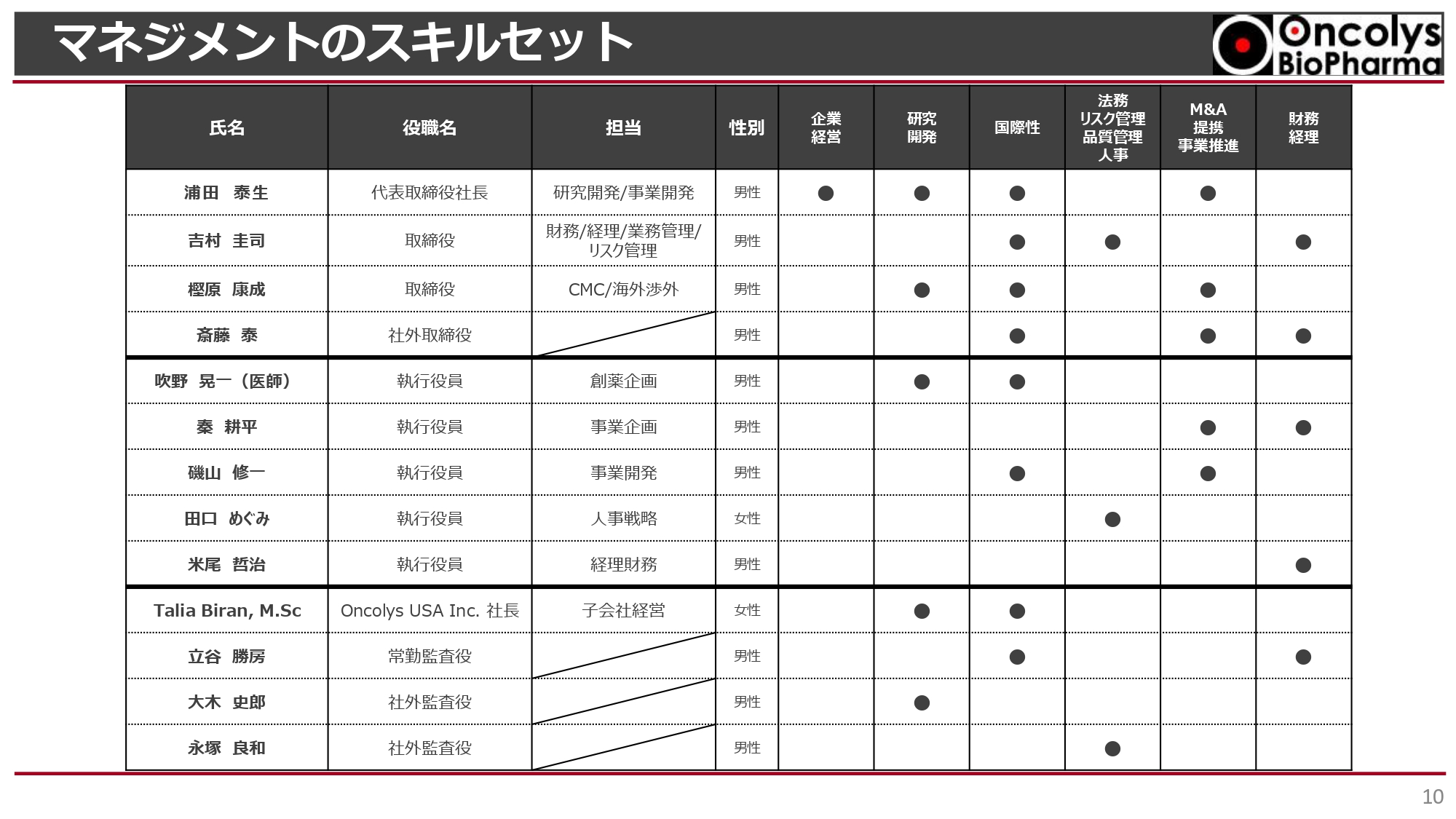
企業経営、研究開発、国際性、法務・リスク管理・品質管理・人事、M&A・提携・事業推進、財務経理において、非常に幅広いスキルセットを持った役員構成になっています。
パイプライン開発一覧
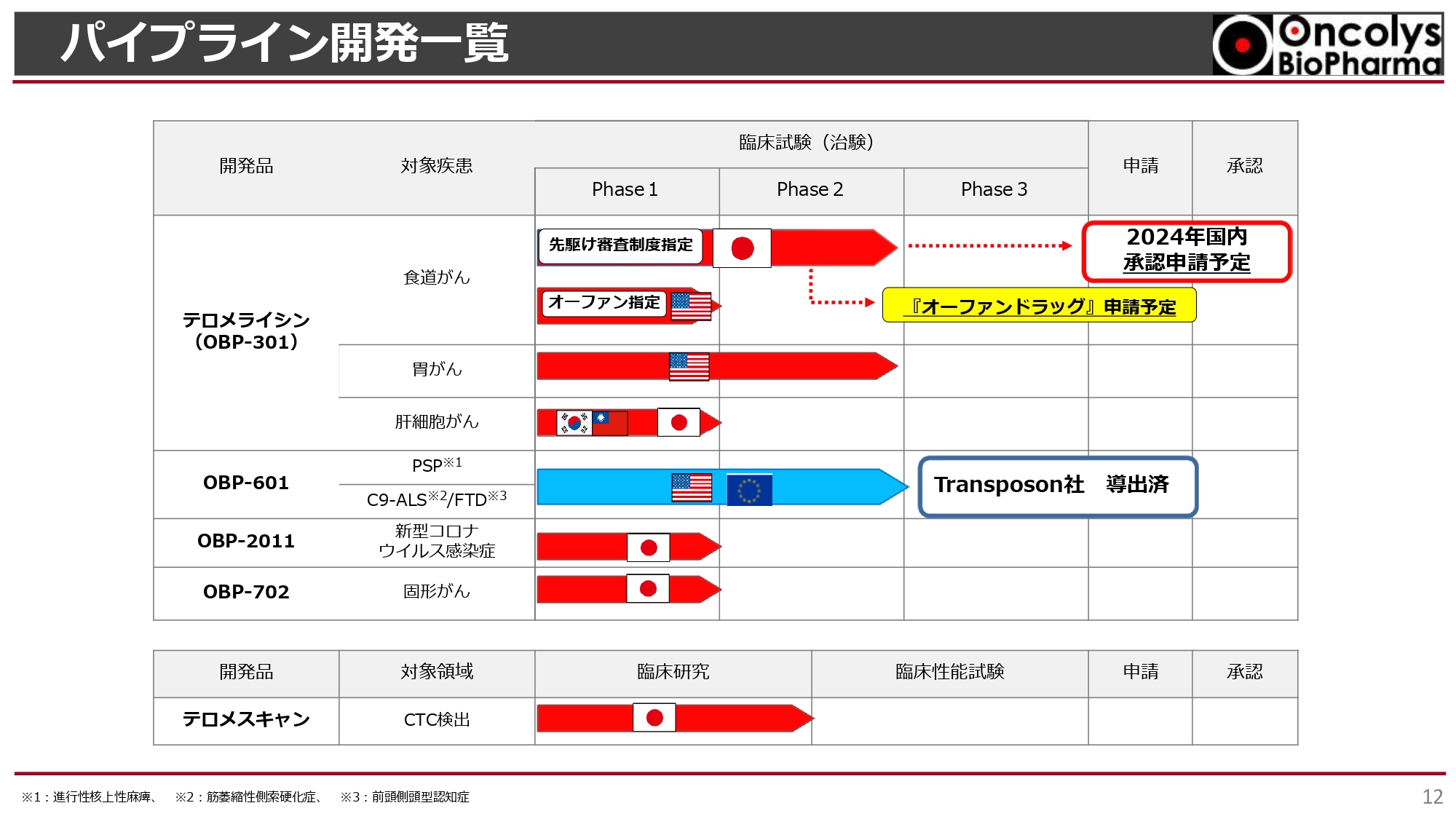
開発パイプラインについてご説明します。スライドは当社のパイプライン一覧です。
一番上の「テロメライシン(OBP-301)」は食道がんを対象とした最終臨床試験が進行中で、2024年度内に承認申請を予定しています。同時に、オーファンドラッグ指定申請を行う予定です。アメリカではすでに食道がんでのオーファンドラッグ指定をいただいています。それ以外にも胃がん、肝細胞がんでの開発が進められています。
「OBP-601」は複数の神経難病に対し、アメリカのTransposon社に導出済みで、Transposon社の費用負担によるPhase2aが進行中です。
新型コロナウイルス感染症治療薬の「OBP-2011」は、昨今の新型コロナウイルス感染症の状況や治療薬の申請状況などを鑑み、現段階では優先順位を下げています。
第2世代の「OBP-702」は前臨床から臨床に進むためのGMP製造を行っているところです。「テロメスキャン」は現在、順天堂大学で臨床研究を行っています。
テロメライシン(OBP-301) suratadenoturev

「がんを切らずに治す」という掛け声のもと、「テロメライシン」の開発が進められています。
2022年のトピックス

「テロメライシン」の2022年のトピックスです。2022年8月に中外製薬からのすべての臨床試験の引継ぎが完了しました。2022年末には放射線併用食道がんPhase2のすべての症例の組入れが完了し、現在その症例のフォローアップをしています。こちらは2024年に承認申請予定です。
臨床試験のトップラインデータは内視鏡判定委員会や効果安全性評価委員会等ですべての評価を行っており、当社にはまだ情報が入ってきていませんが、2023年度中にデータが取得できる見込みです。ウイルスの新しい製造方法の予備検討も完了しました。さらに、PMDAと承認申請に向けた事前相談を開始しています。
当社の「テロメライシン」もいよいよ販売を行うPhaseに差しかかってきましたが、当社はセールスフォースを持たないため、内資・外資も含めた複数の製薬会社と販売提携契約における協議を開始しています。
米国においては「ペムブロリズマブ」併用胃がんのPhase2が行われ、2022年末にすべての組入れが完了しました。この結果をもって、免疫チェックポイント阻害剤を販売する米国大手製薬企業と共同研究・共同開発に向けて協議が開始されています。
国内においては「ペムブロリズマブ」併用食道がんのPhase1について組入れおよび治験が終了しており、2023年4月に行われるAACR(米国がん学会)ですべてのデータを発表する予定です。
テロメライシンの特長

「テロメライシン」は順調に開発が進んでいます。この薬が承認されれば、世界におけるFirst-in-Classな腫瘍溶解性アデノウイルス製剤となります。推定効能・効果は手術不適応な局所進行性の食道がん(放射線治療併用)で、局所がんの治療以外にも、付加価値として嚥下障害や食道閉塞の改善が認められます。
免疫チェックポイント阻害剤も含め、全身に転移した末期の食道がんの治療薬はありますが、いわゆる食道がんの局所をターゲットにした薬は世界のどこにもありません。当社の「テロメライシン」は、そのような食道がんに対するUnmet medical needsに貢献すると考えています。これまでの臨床試験の結果から、重い副作用は報告されていません。
現在、厚生労働省より先駆け審査指定を受け、すでに承認審査に入り各種相談を行っている段階です。
食道がん治療の課題
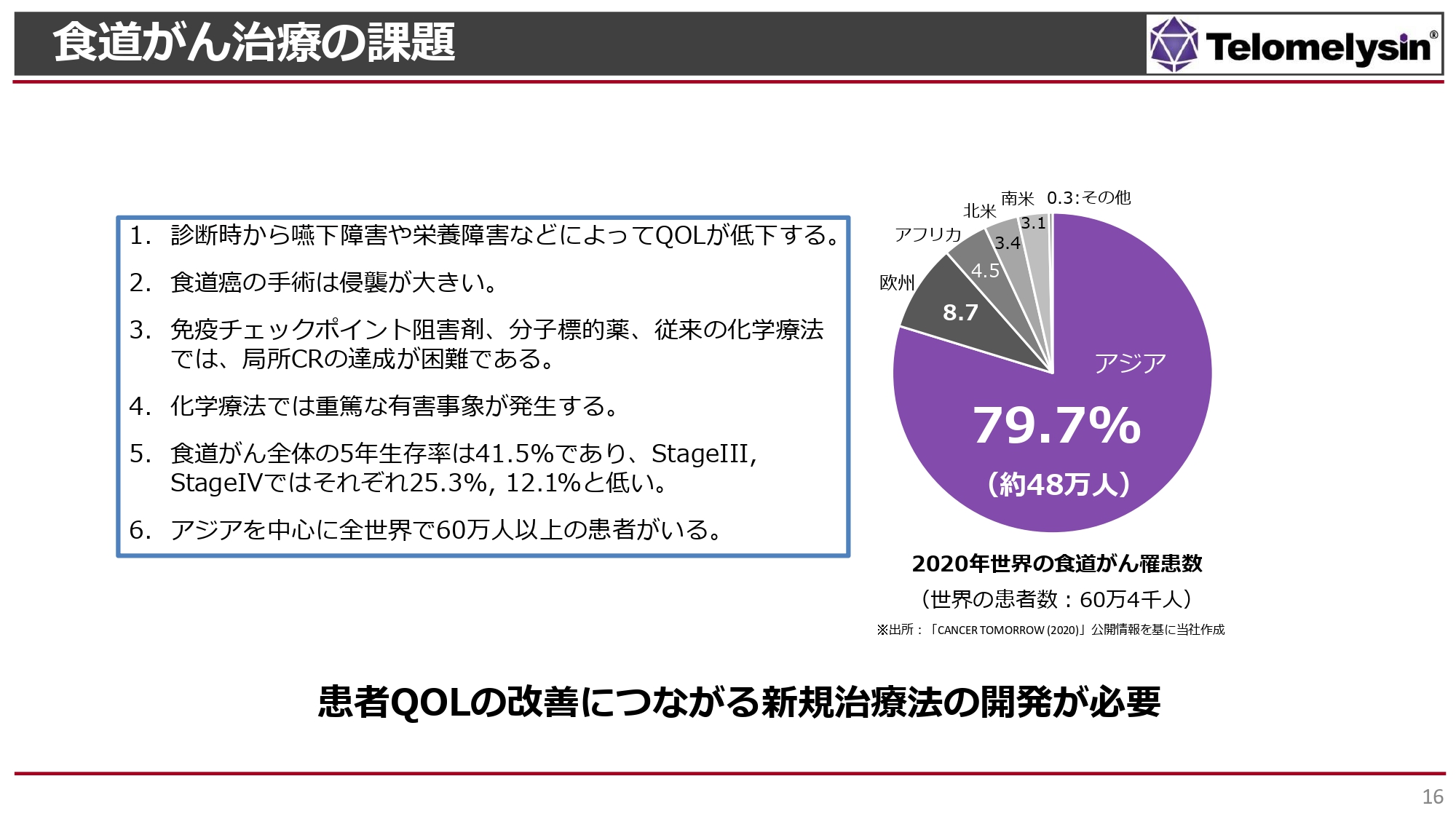
食道がんは非常に治療方法の選択肢が少ないがんで、食事ができなくなるなど、QOLが低下する特徴を持っています。
免疫チェックポイント阻害剤による治療が開始され、StageⅢの後期あるいはStageⅣの患者に適用されています。しかし、StageⅡおよびStageⅢの手術で治る症例に対しては手術または化学療法でしか治癒できない状況で、化学療法は重篤な副作用が出る可能性があります。また、依然として食道がんはがんの中でも5年生存率が低いです。
2024年の承認申請に向けた治験が組入れ完了
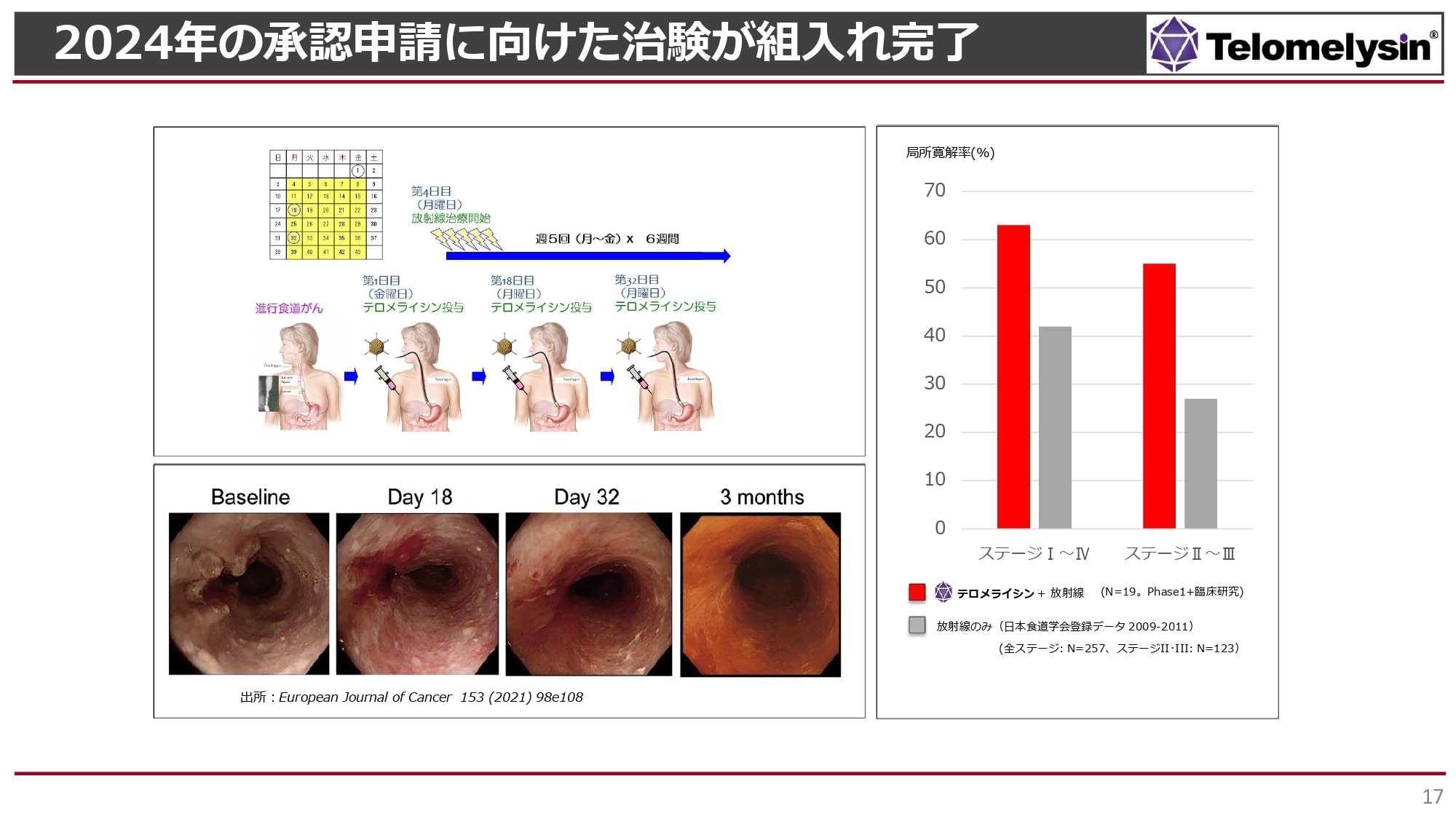
現在進行中のPhase2の臨床試験です。こちらの臨床試験は食道がんのStageⅡあるいはStageⅢを対象にしています。
スライド右側のグラフのように、6週間に渡って毎日少線量ずつ患部に放射線を当てる放射線治療において、単独治療ではStageⅡ・StageⅢの患者に対する局所への奏効率は30パーセントに届きません。
ところが「テロメライシン」併用放射線治療の結果、StageⅡ・StageⅢで局所の完全治癒が55パーセントほど認められました。StageⅠ、StageⅣを含めると完全治癒は60パーセント以上となりますが、現在の臨床試験では対象外です。
スライド一番左の内視鏡写真では食道の左にがんが見られますが、「テロメライシン」併用放射線治療を行うと、3ヶ月後には一番右の写真のように食道が非常にすべすべした、きれいな表面になります。また、大きな食道がんにより食事ができなかった患者が、2ヶ月から3ヶ月の間にきれいに食道がんが消え、食事ができるようになったケースもあります。
このような治療効果が認められることから、厚生労働省に現在の治験についての先駆け審査について働きかけ、指定されました。
テロメライシンの市場規模
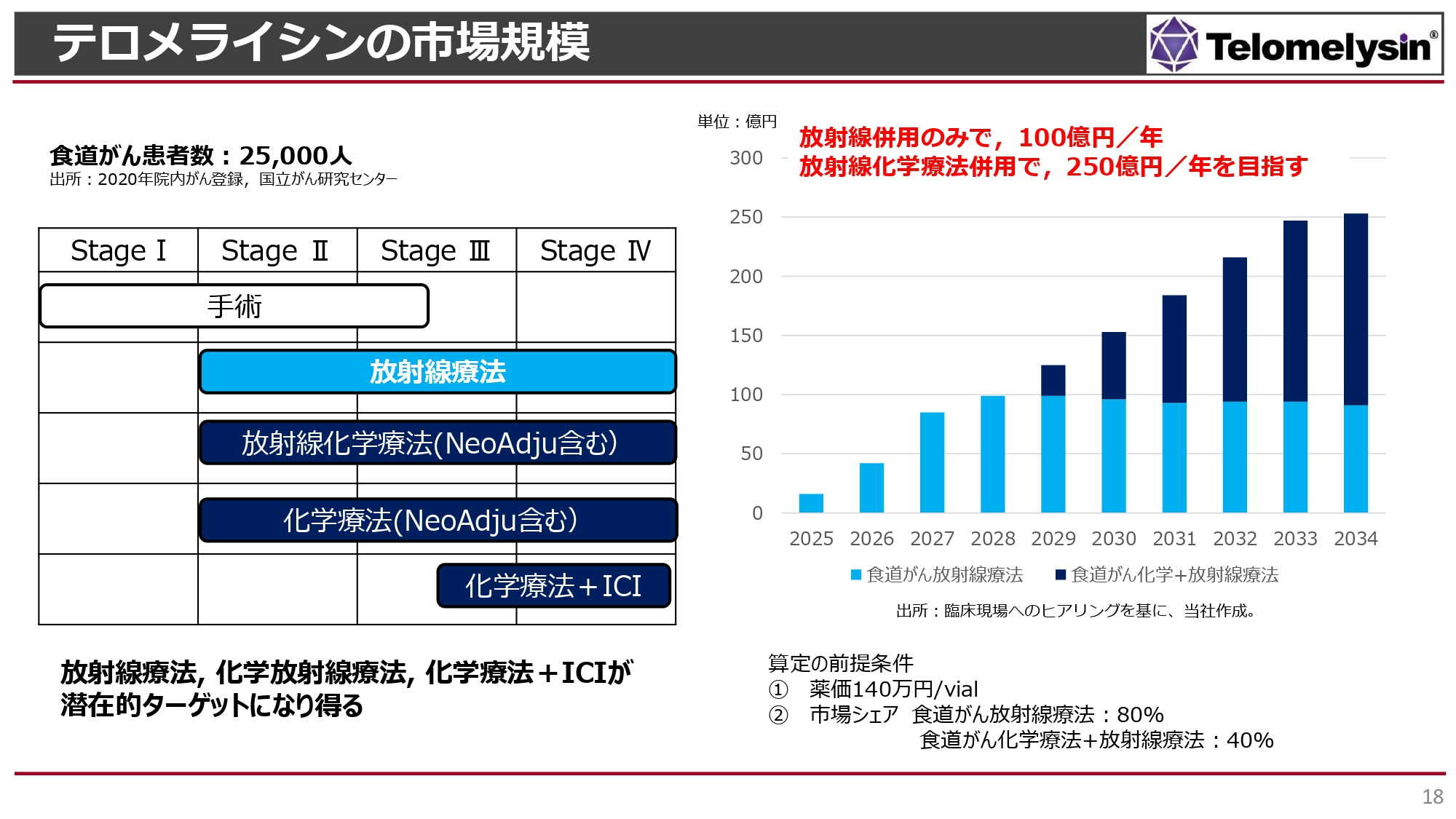
「テロメライシン」が世に出た場合、放射線単独治療に併用します。食道がんの患者は年間2万5,000人くらいです。
初期のStageⅠの患者は可能であれば内視鏡手術で摘出します。一方で、StageⅡ以降になると、放射線化学療法や化学療法単独といった、いろいろな治療の選択肢がありますが、このような治療はある程度、臓器の機能がしっかり保てる患者が対象です。
StageⅡ・StageⅢでは手術も選択肢に含まれますが、8時間から10時間という長時間で患者に大きな負担のかかる手術です。肋骨の間を切り、肺と心臓がむき出しになるため、高齢者や心臓や腎臓、肝臓に障害がある患者はなかなか耐えられません。このような手術に耐えられず化学療法も受けられない方には放射線治療しか選択肢がありません。
食道がん患者全体の約10パーセントが放射線治療単独でしか治療できないのが現状です。今後、このような患者を対象に「テロメライシン」を販売していきますが、薬価がどれくらい付くかはまだわかりません。
先に承認されているヘルペスウイルスの製剤「デリタクト」の薬価は1バイアルあたり140万円です。これを勘案すると、当社は1例あたり3回「テロメライシン」を投与しているため、1例あたり約400万円の薬価になると考えられます。したがって、2025年の発売後、2028年頃までに100億円のピークセールスに達すると考えています。
当社としては薬価140万円を基準とするのではなく、原価計算を行ってもう少し高い薬価を目指していきたいと考えています。その場合には、ピークセールスはもう少し高くなる見込みです。
2029年以降は効能追加を行い、放射性化学療法併用への適応を取得できれば、売上が倍増する計算です。
2024年承認申請に向けて
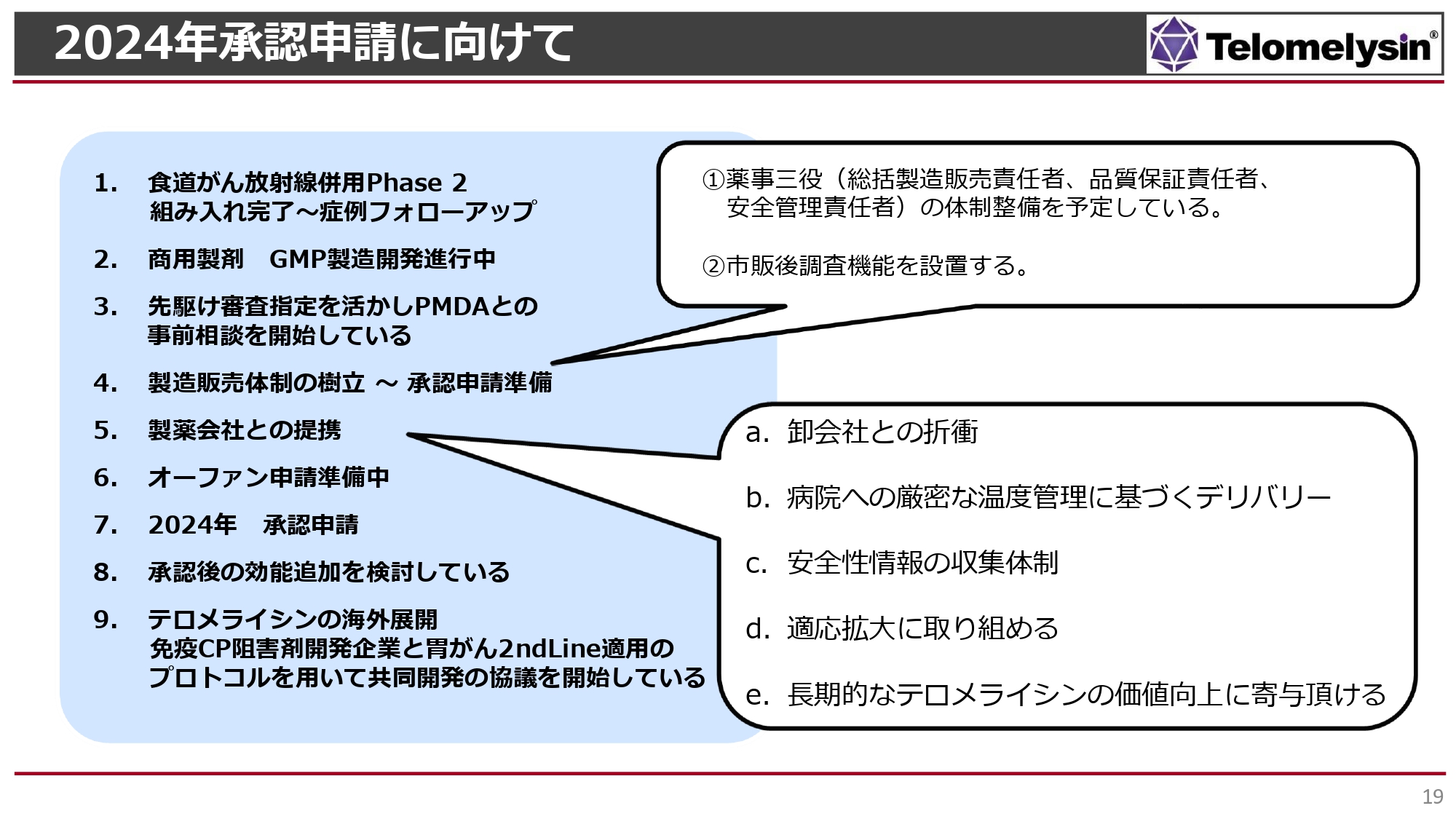
現在、2024年末までの承認申請に向けて、臨床試験に参加している患者の生存率など分析の上、フォローアップを行っています。製造においては、最終的にGMP製造ができるかどうかというチャレンジをしており、これが順調に進めば年内に商用製造できると考えています。
先駆け審査を活かして、PMDAとの事前相談が開始されています。また、製造販売体制の樹立や製薬会社との提携を進めています。これまで当社は製造販売体制を持っていなかったため、今後、薬事三役といわれる総括製造販売責任者・品質保証責任者・安全管理責任者とともに体制を確立していく必要があります。現在その採用を行っており、かなり目処が立ってきています。それ以外にも、市販後調査や安全性のフォローアップ機能を充実させる必要があると思っています。
製薬会社との提携については、卸会社との折衝、厳密な管理のもとすべての病院にデリバリーできる、安全性情報などを収集できる、今後の適用拡大にも一緒に取り組めるといった点から、「テロメライシン」の長期的な価値向上に寄与していただける会社との提携を目指しています。現在は内資企業・外資企業を含めて、複数の会社と最終的な条件の詰めに入っています。
また、厚生労働省に対してオーファンドラッグの申請を行いたいと思っており、こちらは2023年度内にできる可能性もあると考えています。今後も効能追加を検討し、海外展開をしていきたい考えです。
ペムブロリズマブ併用胃がんPhase2は発展的終了
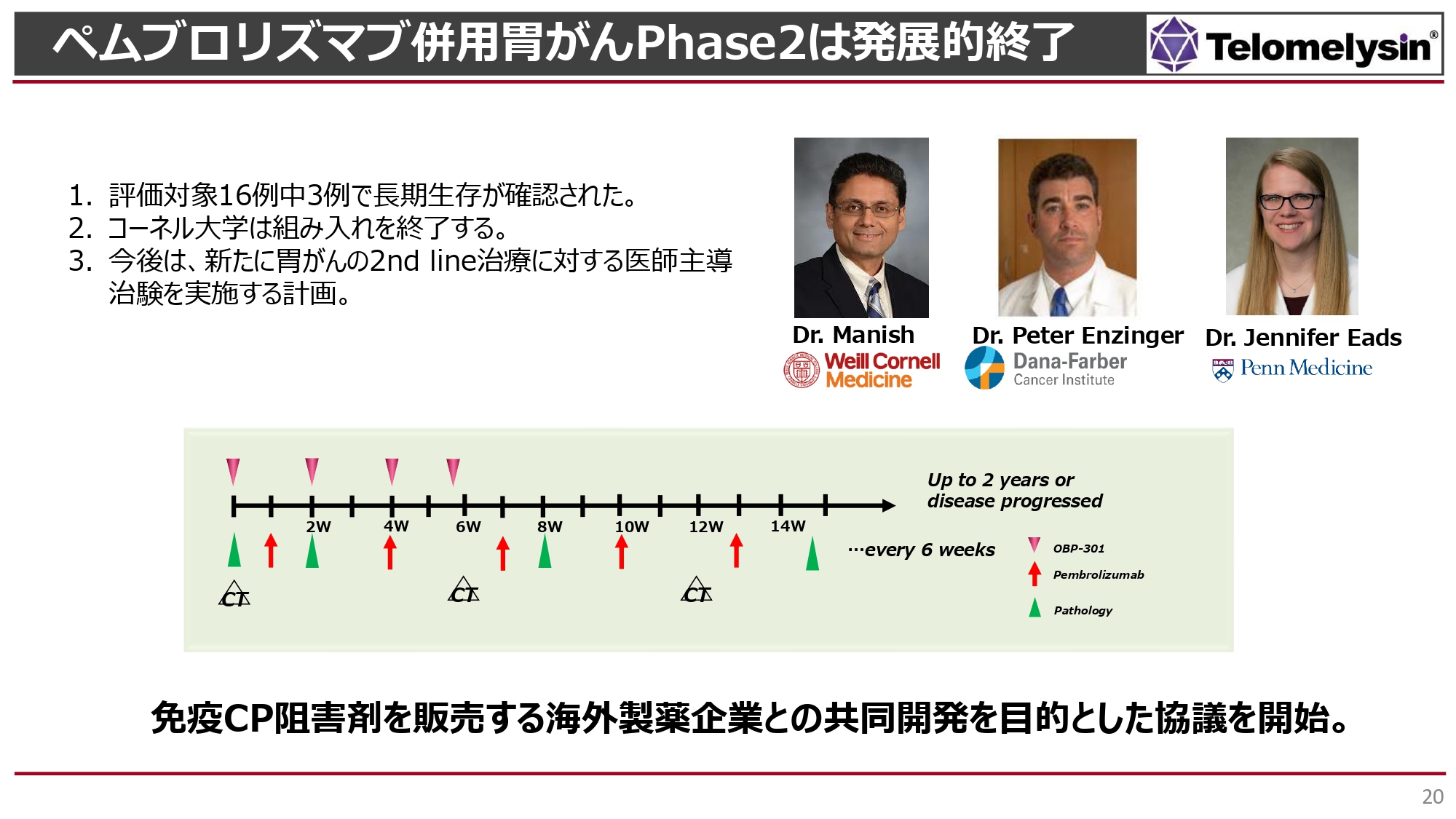
海外の治験の状況をご説明します。非常に時間がかかりましたが、コーネル大学で「ペムブロリズマブ」のみを併用した胃がんを中心にした臨床試験を行い、現在16例の組入れが完了しました。16例中3例で長期間の生存が確認されており、化学療法を使わない臨床試験の結果としてご評価をいただいています。
今後は「ペムブロリズマブ」単独で胃がんを治療するというレジュメがアメリカではなくなり、「ペムブロリズマブ」と化学療法を行うことがスタンダードになっていきます。このような状況から、当社は今後胃がん領域において、ファーストラインではなくまだアメリカではガイドラインに載っていないセカンドライン治療における治験を実施する計画です。
ファーストラインで「ペムブロリズマブ」と化学療法で効果が出なかった患者にも、セカンドラインにおける「テロメライシン」併用で再び「ペムブロリズマブ」が効くようになるというデータも出ています。「ペムブロリズマブ」併用のセカンドラインの治療プロトコルが海外の製薬企業に認められた場合には、チェックポイント阻害剤を販売する製薬企業と共同開発ができるようになると考えています。
これについても、2023年上半期には結論を出したいと考えています。
2022年のトピックス

神経難病への可能性を追求している「OBP-601」についてご説明します。「OBP-601」は、10年ほど前までHIVの治療薬として開発されてきました。非常によい結果が出たのですが、当時提携していたブリストル・マイヤーズ スクイブ社がHIVのフランチャイズから降りると判断したため、Phase2b試験が成功したにもかかわらず、ライセンスが当社に戻ってくるという残念な状況となりました。
その後いろいろな効能を考え、最終的には神経難病に効く可能性があるという結果が出たため、現在はTransposon社にライセンスを行い臨床試験が行われています。
PSPと呼ばれる進行性核上性麻痺は、2022年にアメリカで二重盲検試験のPhase2a試験の組入れを完了しました。これにより、2023年度中にTransposon社よりトップラインの解析結果が入手できる状況になりました。
加えて、C9-ORFという逆転写酵素が異常発現しているALSあるいはFTDの試験も同時に進行しており、こちらのPhase2a試験の組入れがあと少しで完了します。
レトロトランスポゾンとは
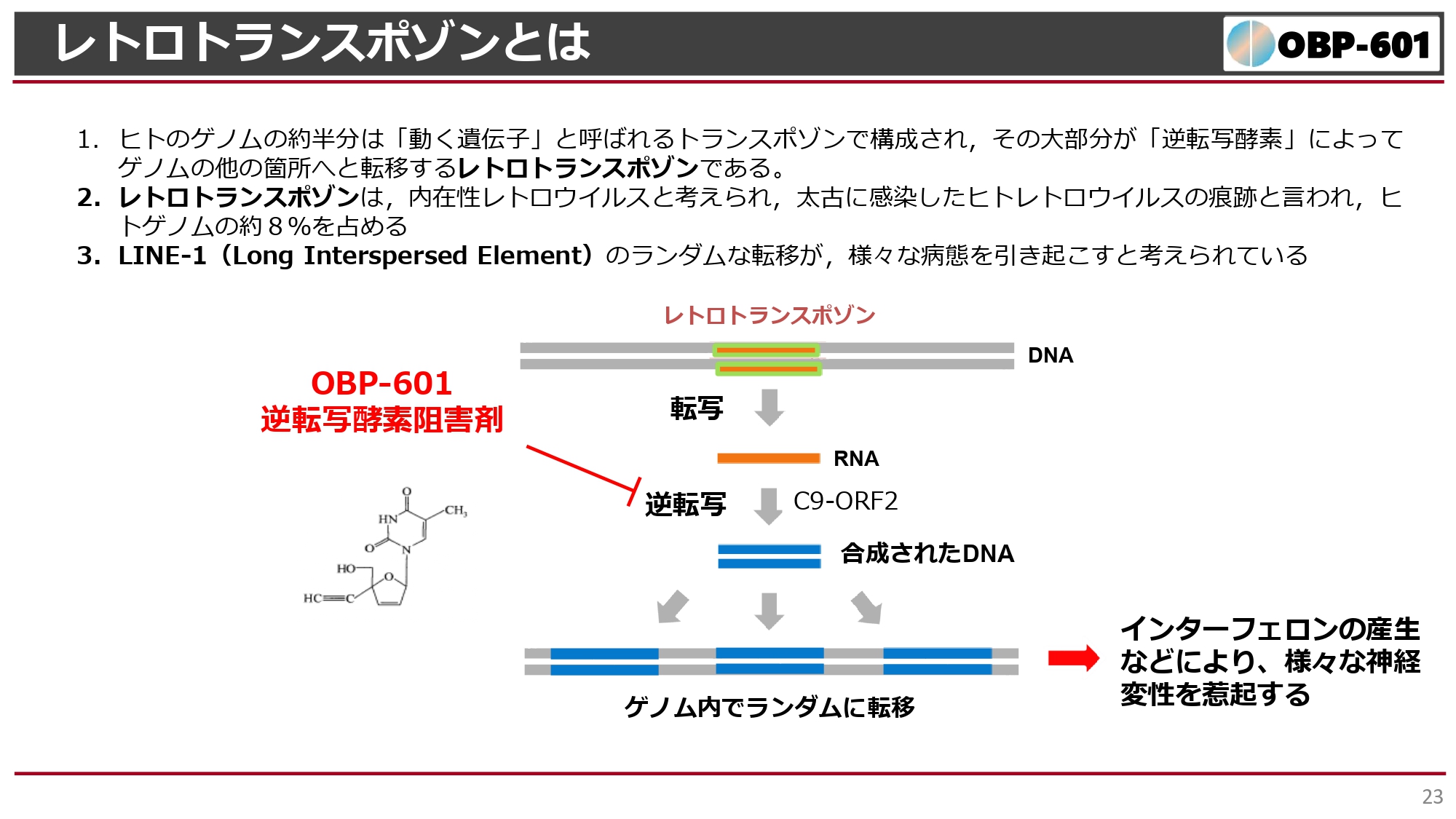
「601」は、もともとはレトロウイルスの増殖を抑制する逆転写酵素阻害剤として開発を開始しました。逆転写酵素は、私たちの生体にもたくさん存在しています。
DNAには、太古にさまざまなレトロウイルスに感染してきて出来上がったレトロトランスポゾンという機能不明な遺伝子があるのですが、逆転写酵素であるC9-ORF2が活性化すると、レトロトランスポゾンがゲノム内でランダムに過剰に転移してしまう現象が起こります。
それにより、一番問題になるのがLINE-1(Long Interspersed Element)です。LINE-1というゲノムが広がると、生体内でインターフェロンなどの産生が局所で行われ、特に神経を損傷する現象が認められています。アルツハイマー病でも同じような現象が見られます。
開発の着眼点
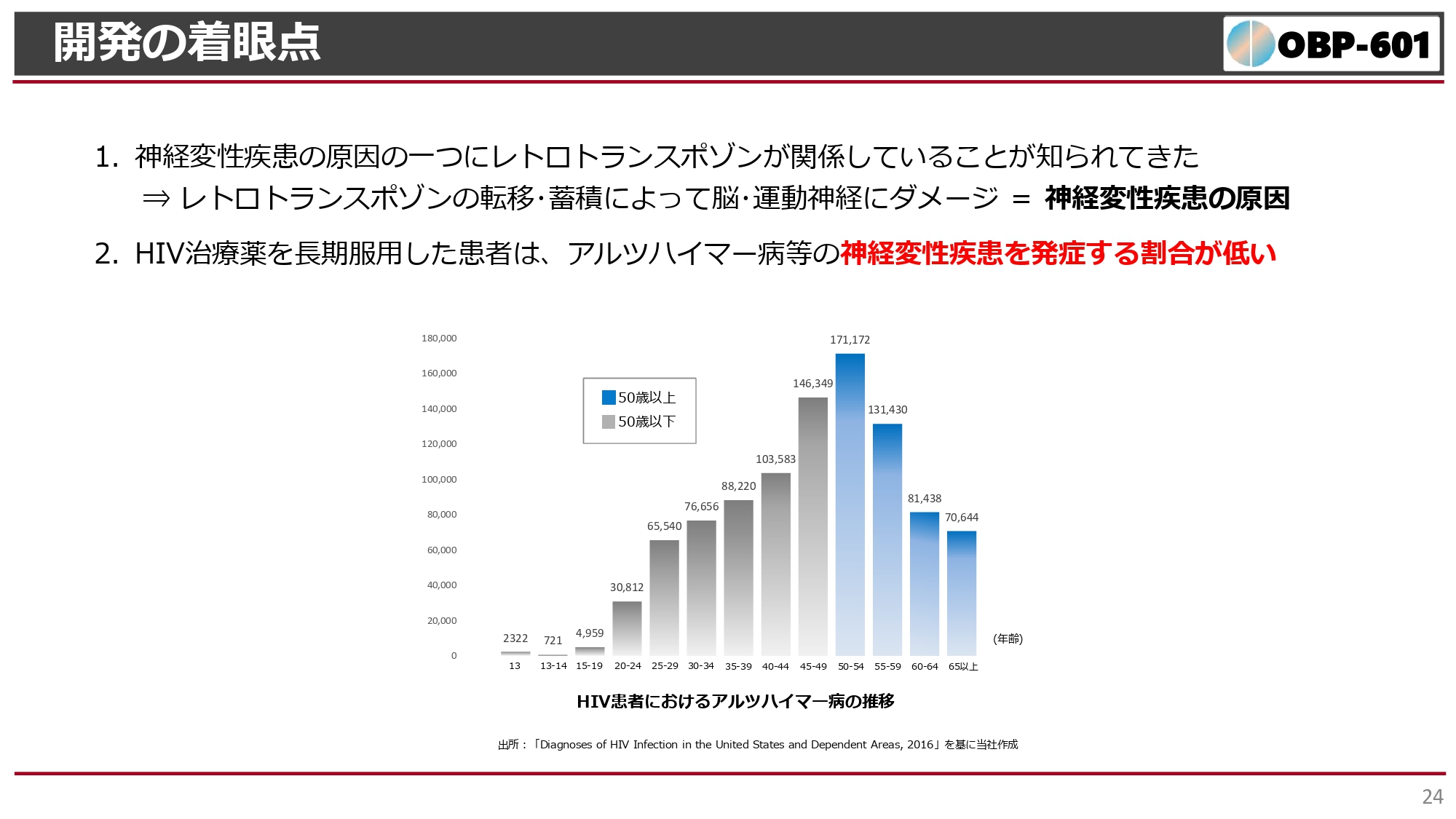
スライドのグラフは、年齢別のHIV患者におけるアルツハイマー病への罹患率を示しています。40代から50代をピークに、それ以降はアルツハイマー病への罹患率が減少しています。
アメリカの統計によると、50代ぐらいの患者は1980年代ぐらいから抗HIV薬である逆転写酵素阻害剤を長期間服用している方が多く、HIVに罹患しても継続して薬を飲んでいればアルツハイマー病にならないという結果が出ています。
OBP-601の特徴
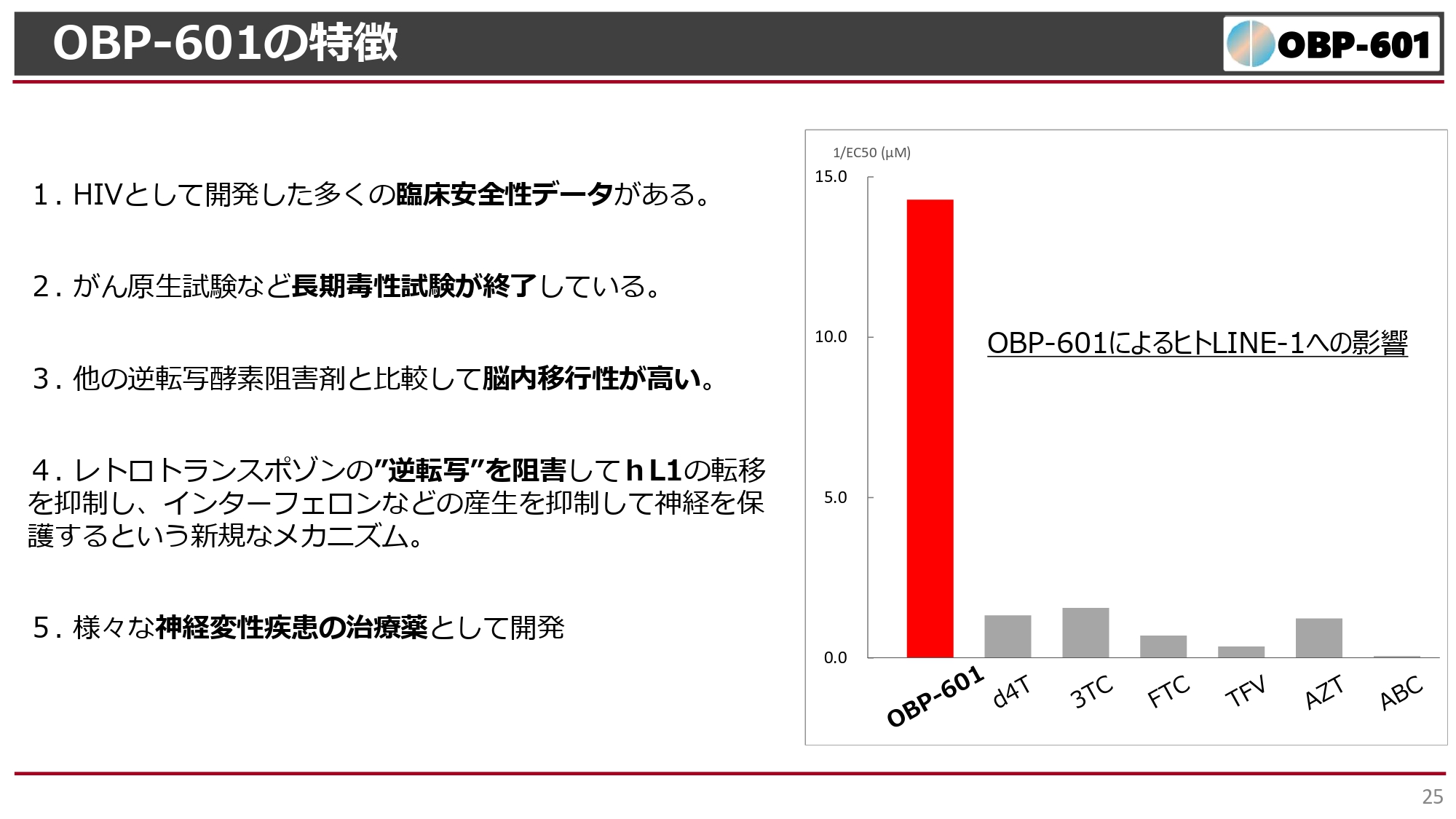
こちらに関連して、アメリカのブラウン大学は「OBP-601」に着目し、体内の逆転写酵素による働きについて実験結果を示してきました。「OBP-601」は、すでに抗HIV薬で多くの患者に長期間投与されています。また、一般的に医薬品開発で最後に行われるがん原性試験なども完了しています。さらに、脳内移行性が他の薬に比べて高いことが示されています。
スライド右側のグラフを見ると、「OBP-601」によりヒトLINE-1の転移が抑制されており、「OBP-601」はC9-ORFという逆転写酵素を強く阻害して神経難病に効きやすいことがわかります。「d4T」「3TC」「FTC」はすでに市販されていて、ジェネリックになっている抗HIV薬です。これらと比べると、「OBP-601」のトランスポゾンに対する影響がはるかに強いという結果です。
このような状況をもとに、すでに臨床試験が開始されています。
ライセンスと開発状況

Transposon Therapeutics社とは、2020年に独占的なライセンス契約を結んでいます。契約総額は3億ドル以上で、ロイヤリティーを含めた契約総額は日本円で400億円近い金額となっています。
欧米でPhase2a試験を行っており、スライドに赤枠で示したPhase2a試験の進行性核上性麻痺(PSP)40例という目標はすでに達成されていて、年内にトップラインデータが出てきます。
筋萎縮性側索硬化症(ALS)・前頭側頭型認知症(FTD)も40例を目標としており、あと少しというところです。順調に進めば2024年中にトップラインの結果が出てくる可能性もあります。
OBP-601 市場性
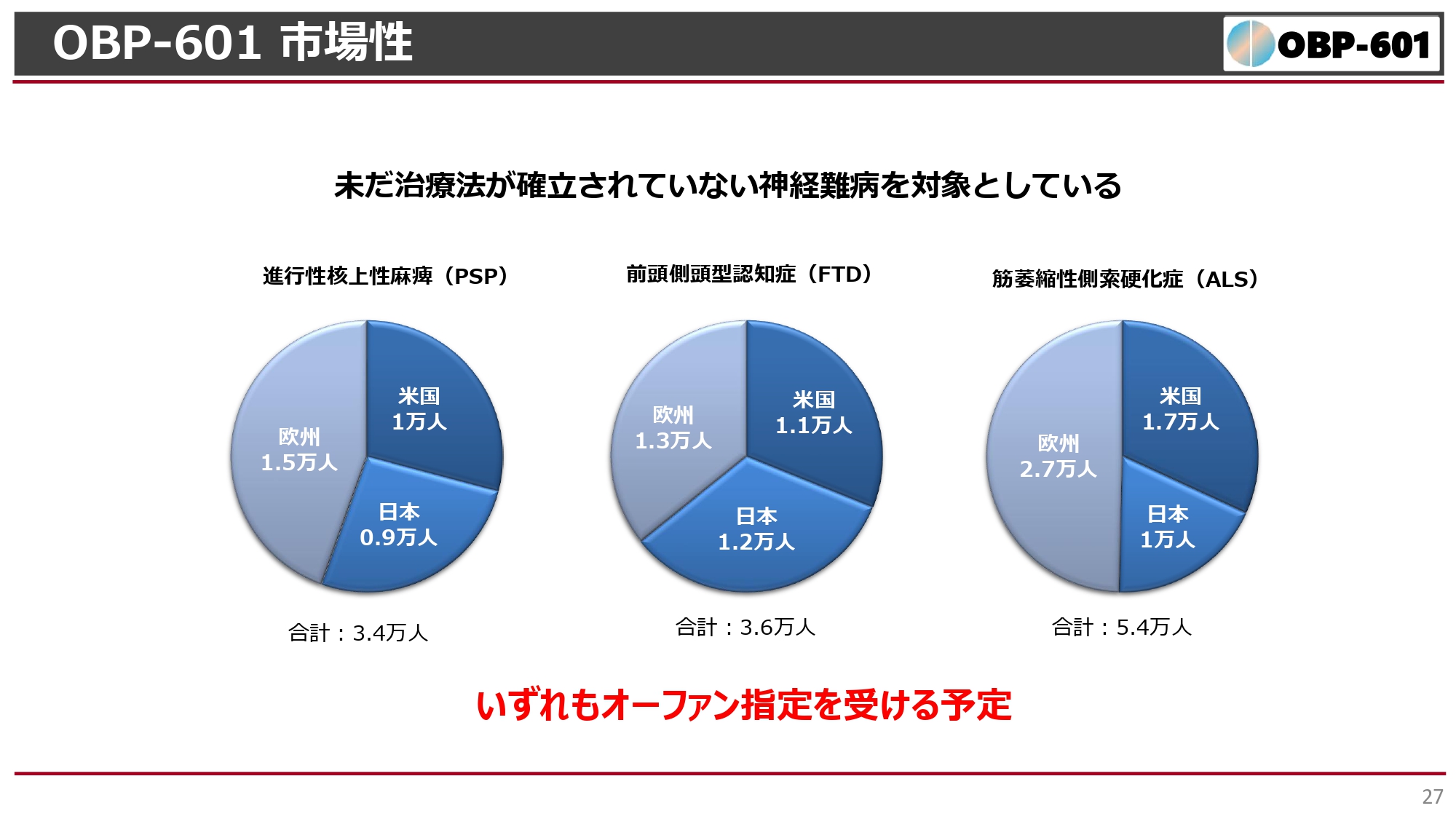
このような難病は社会的には非常に数が少なく、オーファン指定を受けるような疾患です。PSPの患者は世界で3万人程度、日本で1万人程度と非常に少なく、FTDやALSは日本で1万人程度、世界でも3万人から5万人と治療例もほとんどない領域です。ALSの治療薬は出ていますが、まだまだ新しい薬が望まれています。
このような病気に対して、進行を抑制する、あるいは症状を改善する薬を開発できれば、大変大きなマーケットを獲得できると期待しています。
その他パイプライン 2022年のトピックス

その他のパイプラインについてご説明します。「OBP-702」は第2世代の「テロメライシン」です。こちらも現在、GMP製造を開始しています。岡山大学では、すい臓がんに対する臨床研究が計画されています。
新型コロナウイルス治療薬である「OBP-2011」は、現在鹿児島大学と国立感染症研究所でメカニズムの解明を行っています。メカニズムが確立されれば、新型コロナウイルスのみならず、それ以外のウイルスでの治療に使えないか探索を進めていきたいと考えています。
「テロメスキャン」については、自動検出ソフトウェアの開発をCYBO社と行い、順天堂大学で研究が進められています。
カタリストの進捗状況(1/2)

2022年8月に公表したカタリストの進捗状況です。食道がんのPhase2試験の組入れ、先駆け審査指定の承継は完了しています。それ以外の商用GMP製造完了ならびに品質試験法の確立、自社での国内の製造販売体制の確立、国内の販売パートナーの獲得は年内完了を予定して進行しています。
コーネル大学での胃がんCPi併用Phase2試験の学会発表は、今後のパートナーとの条件による影響があるため、進行中と表記しています。
カタリストの進捗状況(2/2)

「OBP-601」は、PSPは完了し、その他は年内完了となります。それ以外のパイプラインについては進行中です。
まとめ 2023年に期待頂きたい事項

今後当社に期待していただきたいことをお話しします。「テロメライシン」の国内販売パートナーへの提携が目前に来ています。こちらの製造販売体制も年内には確立したいと思っています。
また、食道がんに対するトップラインデータが年内に出てくるため、きちんとしたデータが得られたらみなさまにお知らせしたいと思っています。「OBP-601」のトップラインデータも年内に取得できるようになっています。
海外製薬企業との、アメリカでの共同開発契約が締結できれば、当社の事業に対する非常に大きなインパクトになると思います。みなさまには、今後このようなことを見守っていただきたいと考えています。
質疑応答:「テロメライシン」の販売提携について
司会:「テロメライシン」について上市後の販売提携を考えているということですが、引き合いの状況はいかがでしょうか?
浦田:国内にある複数の外資企業や国内の製薬企業から「テロメライシン」を販売したいという申し入れを受け取っています。こちらについては、現在協議中で、できるだけ早い段階で1社に絞って条件を進めていきたいと考えています。
質疑応答:「テロメライシン」のバリデーションの進行状況について
司会:「テロメライシン」の製造プロセスのバリデーションの進行状況を教えてください。
浦田:これまで「テロメライシン」は、ベルギーにあるヘノジェン社で製造工程の開発を行ってきました。いよいよ製造工程が固まってきたため、GMP製造に移行しています。
その結果が2023年上半期に出てくるため、状況によりますが、2023年の下期には商用製造にかなり近い段階での最終製造を行い、それによって2025年の販売の段階では十分な製剤がそろうよう準備していきたいと考えています。
質疑応答:免疫チェックポイント阻害剤を保有する製薬会社との交渉状況について
質問者:免疫チェックポイント阻害剤を保有する製薬会社との交渉状況について、提携の時期や開発対象となる適応症の見込みなどを含め可能な範囲で教えてください。
浦田:インサイダー情報になるため詳細は控えますが、胃がんあるいは胃・食道接合部がんに対してそれなりの成績が出ています。
現在、セカンドラインでの治療法を確立するための臨床試験プロトコルをコーネル大学と作っており、それが相手会社に認められれば、できる限り早い段階で共同開発提携を行っていきたいと考えています。こちらも提携でき次第、みなさまにお知らせしていきたい考えです。
質疑応答:アステラス製薬の「ゾルベツキシマブ」との競合について
質問者:アステラス製薬の「ゾルベツキシマブ」がHER2陰性の局所進行性または転移性の食道がん、胃・食道接合部がん対象にしたPhase3試験で優位な延長を見せたという発表がありました。「テロメライシン」のライバルとなる可能性がありますが、どのように考えればよいでしょうか?
浦田:今、日本で行われている「テロメライシン」の放射線併用の食道がん臨床試験は、食道がんの局所に対する効果を示したものであり、臨床試験の対象はStageⅡおよびStageⅢです。
一方「ゾルベツキシマブ」は、Stageの遅い患者に対する全身治療を目指した臨床試験だと考えています。エンドポイントとして生存率、あるいは無悪性の生存率を見るような臨床試験で、当社とは評価の見方が違う試験です。
そのため、ライバルになるというよりも、将来的にはそのような薬剤との併用によってより効果が高められるような方向を目指せるとよいと考えています。
質疑応答:「抗PD-1抗体ペムブロリズマブ」併用食道がん治験のAACRでの発表について
質問者:4月に発表を計画している「抗PD-1抗体ペムブロリズマブ」併用の食道がん治験のAACRでの発表内容は、どのような内容を想像しておけばよろしいでしょうか?
浦田:こちらは医師主導の治験で、現在国立がんセンター東病院において発表内容が吟味されているところです。この臨床試験はステップ1、ステップ2に分かれています。ステップ1はすでにアメリカのがん治療学会の中で発表されており、9例中3例に局所でよい効果が得られているということでした。
おそらく、次のAACRの発表では長期生存率などが加わってくると思います。さらに「テロメライシン」を投与して長期生存できた患者に関するさまざまな臨床パラメーター、あるいは遺伝子のパラメーターなどが発表されるのではないかと考えています。
質疑応答:「テロメライシン」承認取得後の次期戦略について
質問者:「テロメライシン」で放射線併用食道がんの承認を取得した後の、適応拡大を含めた戦略をスケジュール感も含めて教えてください。
浦田:放射線治療単独が適用となるのは、全食道がんの10パーセント程度にあたる2,000人から2,500人ぐらいの患者です。一方で、放射線化学療法のマーケットはその倍以上になると考えています。
そのため、開発資金やパートナーとの協議によりますが、日本国内における放射線化学療法に対する臨床試験をできる限り早く進行できれば、2028年あるいは2029年の適応追加が可能になると考えています。
具体的には、放射線化学療法への「テロメライシン」の上乗せによって治療効果が高まる、あるいは手術をする患者が減るということを治療効果として、できるだけ早く進めていきたいという考えです。
質疑応答:MRの採用を含めた今後の人材計画について
質問者:「テロメライシン」の承認取得の上市を念頭に置いた今後の人材計画について、現在の社員数は40名弱ですが、強化が必要な部分を含めて何名程度の水準を想定していますか? MRの採用を含めてどのような検討状況か教えてください。
浦田:第一に急がなければならないのが、製造販売体制樹立のため、少なくとも総括責任者・品質保証責任者・安全性保証責任者の3名が必要です。そのうちの1人はすでに確定していますが、ほかの2名はもう少し採用を急がなければならない状況です。
それ以外にも安全性情報の統計解析などを担当する方を若干名採用していきます。それに伴って、臨床開発の人数ももう少し増やしたいと思っています。
MRについては、当社は現段階ではセールスフォースを持たず、セールスは国内の製薬企業さまに担当していただきたいと考えているため、現段階ではMRの採用は考えていません。
質疑応答:偶発債務の金額規模および内容について
質問者:本日発表の決算短信の中では、偶発債務のことについて記載がありますが、金額規模およびその内容について教えてください。
吉村:今日発表した決算短信の中でも触れていますが、総額95万ドルの製造委託の製造開始初期の段階において逸脱事故が発生しました。
それについて、委託先から費用の一部を負担してほしいという交渉がありましたが、我々との間で具体的な金額はまだ決まっていません。こちらを経理上引当金計上する、あるいは未払い計上するという、具体的な金額が見積もれる段階ではないため、偶発債務として処理しています。
質疑応答:「OBP-601」の中間解析結果入手の時期について
質問者:「OBP-601」に関して、2023年に中間解析結果を受領する見込みとのことですが、2023年のいつ頃にどのような内容で入手する予定でしょうか?
浦田:Transposon社からまだ詳細を受け取っていないものの、現在の状況でいくと2023年の下期までの間には入手できると考えています。進行性核上性麻痺(PSP)は体が震えるなどパーキンソン病に非常に似た症状を示すのですが、「OBP-601」によりそのような症状がどのくらい改善するのか、あるいは進行が止まるのかという有効性に関するおおよその結果が出てくると聞いています。
そのほか有効性の持続などの詳しい状況は、おそらく2023年の終わり頃に、トップラインのデータと詳細なデータとが分かれて発表されるのではないかと考えています。
この結果がよい場合には、次に大規模で最終的な臨床試験が行われます。再び大きな資金が必要となるものの、「OBP-601」が難病に効くことが分かれば、大手製薬メーカーへTransposon社からの再ライセンス契約にかなり近づくのではないかと期待しています。
質疑応答:2023年12月期の研究開発費について

質問者:2023年12月期の研究開発費の計画について教えてください。
吉村:2023年度の業績目標の数値については非開示としているため具体的な数字は申し上げられませんが、国内における我々のメインの開発である放射線併用食道がんのPhase2の組入れは終了しているため、今期の臨床に関わる費用は減少していきます。
しかしながら、2024年の申請に向けてのさまざまな費用は今後も発生していく予定です。また、メインになると思われる製造費用については費用が発生すると思います。
質疑応答:「C9-ALS/FTD」に関する現在の状況および今後の見通しについて

質問者:今回の決算発表の中ではPSP Phase2aへの組入れが完了し、2023年に中間的な解析結果を受領見込みとのことでした。もう1つ走っている「C9-ALS/FTD」の現在の状況および今後の見通しについて教えてください。
浦田:「C9-ALS/FTD」については、目標40例に対してあと少しというところまできており、おそらく2023年の上半期には組入れが終わるだろうと考えています。その場合、トップラインデータは早くて2023年末、もしくは2024年の2月頃には出てくるのではないかと期待しています。
こちらは他に治療薬のない疾患であるためプラセボと比較しています。何も処置をしない既存のケアをしていた状況よりも、症状が改善する結果が出れば、大きなライセンス契約につながっていくのではないかと期待しています。
質疑応答:「テロメライシン」のトップラインデータや承認時期の見込みについて
質問者:先駆け審査指定で開発している「テロメライシン」の組入れは完了しましたが、トップラインデータや承認時期の見込みを教えてください。
浦田:トップラインデータについては、おそらく内視鏡の結果をご報告することになると思います。現在、京都大学放射線科の武藤教授を中心とした内視鏡判定委員会で、企業の介入なしで判定を行っています。
内視鏡の写真も多く集めていくため、時間がかかっています。2023年の夏頃までにひと通り内視鏡の結果を見ていただいて、その後内視鏡判定委員会の先生方と詳細な議論に入ります。
したがって、どれくらいの患者が治癒したかという結果が出るのは、2023年の秋から冬になる可能性があると考えています。
質疑応答:「テロメライシン」のオーファン申請の条件や現在の検討状況について

質問者:「テロメライシン」の2024年承認申請に向けて、オーファン申請の条件や現在の検討状況について教えてください。
浦田:承認申請においては、食道がんの局所の反応だけではなく、セカンダリーエンドポイントになっている生存率などもすべて勘案して承認申請に向かうことになると思います。
24週間、だいたい半年間のフォローが1つの条件になっており、最終症例が年末に入っているため、その患者さまのフォローが夏頃に終わります。その後データを固定するまでにそれなりの時間がかかるため、2024年の下期に承認申請ができるような状況になるのではないかと期待しています。
オーファン指定については、ある程度の効果が出た段階でPMDAと相談します。ほかの治療法がない5万人以下の患者というルールがありますが、申請を出せばおそらく通ると思います。こちらもデータの出方によるものの、できるだけ2023年内に、遅れても2024年までにはオーファン申請を出したいと考えています。
質疑応答:「テロメライシン」の薬価について
質問者:「テロメライシン」の将来は未確定ではあるものの、薬価および薬価を少しでも高くするような方法についてどのようにお考えか教えてください。
浦田:第一三共が販売している治療用ヘルペスウイルス「デリタクト」が1瓶約140万円です。PMDAとはできる限り原価方式という薬価算定で価格を決めていきたいと考えており、それがきちんと通れば、140万円以上の薬価が取得できると期待しています。
質疑応答:「テロメライシン」の販売提携パートナーの選定基準について
質問者:「テロメライシン」の販売提携において、どのような基準でパートナー選定を進めていくのか教えてください。

浦田:卸対応やデリバリーをしっかり行っていただくのはもちろんのこと、それ以外にも、今後適応拡大に向けて一緒に肩を組んでもらえるような会社と提携したいと考えています。ただ単に売るということよりも、中長期的にテロメライシンの価値向上に寄与いただけるような、追加の臨床試験にも共同で取り組んでいただける会社を考えています。
浦田氏からのご挨拶
浦田:2023年度は、オンコリスバイオファーマにとって大変エポックメイキングな1年になると予想しています。多くのトップラインデータが出てきますし、製薬企業との新たな販売提携も計画されています。海外においても、大手チェックポイント阻害剤を販売するような製薬メーカーと組んで共同開発する体制をとれるようになるかどうかという年になります。
そのような意味で、みなさまにはいろいろとご期待いただきたいと考えており、我々も一丸となってゴールまで全速力で進んで行きたいと考えています。今後ともご支援、ご指導のほど、よろしくお願い申し上げます。
この銘柄の最新ニュース
オンコリスのニュース一覧- 明日の決算発表予定 トヨタ、東エレク、伊藤忠など288社 (2月5日) 2026/02/05
- 腫瘍溶解ウイルスOBP-301製剤の18か月安定性試験結果のお知らせ 2026/02/05
- 前日に動いた銘柄 part2 マツモト、ヒーハイスト、ククレブなど 2026/02/04
- 新興市場銘柄ダイジェスト:エクサウィザーズが続伸、シーユーシーが急騰 2026/02/03
- 注目銘柄ダイジェスト(前場):TDK、京セラ、村田製など 2026/02/03
マーケットニュース
おすすめ条件でスクリーニング
オンコリスバイオファーマの取引履歴を振り返りませんか?
オンコリスバイオファーマの株を取引したことがありますか?みんかぶアセットプランナーに取引口座を連携すると売買履歴をチャート上にプロットし、自分の取引を視覚的に確認することができます。
アセットプランナーの取引履歴機能とは
※アセプラを初めてご利用の場合は会員登録からお手続き下さい。










