【QAあり】オンコリスバイオファーマ、テロメライシンの承認申請で企業価値向上を狙う OBP-601はアルツハイマー病での開発も視野
目次 Agenda
浦田泰生氏(以下、浦田):オンコリスバイオファーマ株式会社代表取締役社長の浦田でございます。本日は大変ご多忙の中、弊社の事業説明会にご参加いただき誠にありがとうございます。
本日は、会社概要に続き「テロメライシン」と「OBP-601」についてお話しした後、当社の近未来への展望をお伝えしたいと考えています。この説明会に何度も足をお運びの方もいらっしゃいますが、初めて参加される方のために基本的な内容も含めてご説明します。
経営ビジョン

当社は「ウイルス創薬」という経営ビジョンを掲げており、パイプラインは世界でも類を見ない構成となっています。
スライド左側のがんのウイルス療法としては、腫瘍溶解性ウイルスの「テロメライシン」や「テロメライシン」の第2世代である「OBP-702」などがあり、ウイルスそのものを使ったがん治療を開発しています。
スライド右側の重症ウイルス感染症治療薬には「OBP-2011」があります。こちらは新型コロナウイルスの治療薬として開発をスタートしましたが、それ以外にもSARS-CoV-2やMERSにも効果があることを確認しています。コロナ禍が収束に向かう現在、さらに幅広いウイルスに効果がないか検証中です。
もともと抗HIV治療薬として開発していた「OBP-601」は、ドラッグリプロファイリングを行い、現在は神経変性疾患の治療薬として開発されています。
我々は、新たな治療薬の選択肢を作り、がん治療の歴史に私たちの足跡を残したいという思いで開発を進めています。「テロメライシン」の実用化が承認されれば、第一歩の足跡をしっかりと残すことができるのではないかと考えています。
会社概要及び株主構成
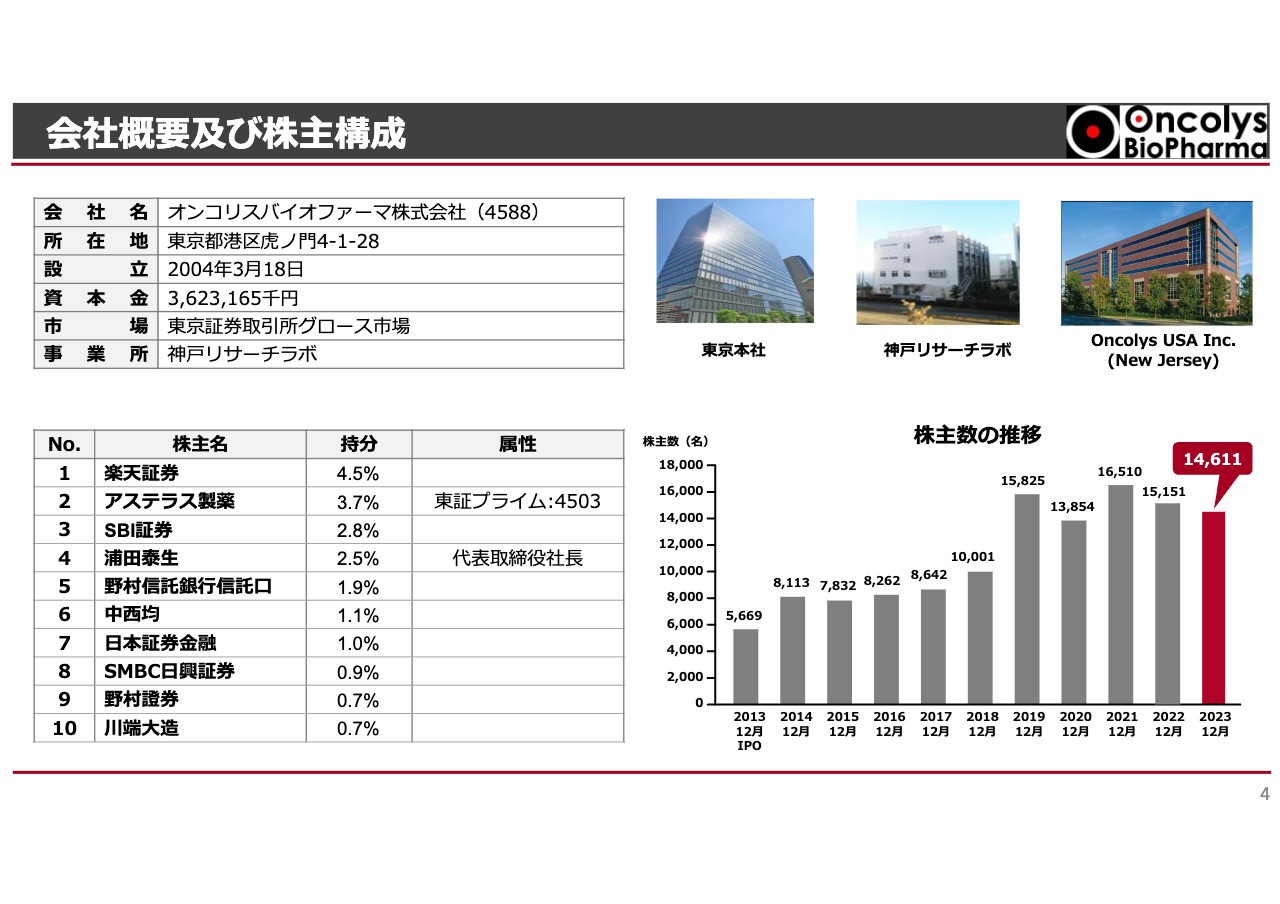
会社概要及び株主構成です。東京本社は虎ノ門タワーズオフィスの一角にあります。神戸リサーチラボは、神戸空港近くの医療センター駅の向かいにある建物の3部屋を借り、ウイルスの製造開発や品質試験の改良などを行っています。Oncolys USAは、アメリカでの臨床試験を担当しています。
株主構成はアステラス製薬が第2位の株主として残っており、昨年末時点で1万4,000名超の株主がいます。
グローバルネットワーク

当社のネットワークです。スライド左側の写真は、鹿児島大学の馬場昌範教授です。彼は感染症治療薬の権威であり、先ほどお伝えしたように、新型コロナウイルス治療薬をさらに幅広いウイルス治療に用いることができないかを検討してくれています。
中央の写真は「テロメライシン」の開発者である、岡山大学消化器外科の藤原俊義教授です。
右側の写真はOncolys USA社長のTalia Biranです。彼女はさまざまな大手製薬メーカーの開発部長を歴任し、アメリカのアドバイザリーボードではよく知られた方です。非常に質の高い臨床試験を実施するために必要な人材だと考えています。
昨年からネットワークに加わったのが、スライド中央の富士フイルム富山化学です。右上のメルク社は、アメリカでの胃がん臨床試験に半額出資して共同開発体制を作ってきたため、名前を記載しています。
ガバナンス体制

当社のガバナンス体制です。取締役は先ほどご承認いただいたとおりですが、ここで当社の執行役員をご紹介します。
佐藤英一郎氏:はじめまして。本年より経営企画担当執行役員を拝命した佐藤英一郎です。効率的な組織運営を心がけ、企業価値の向上に貢献したいと思っています。今後ともよろしくお願いいたします。
田口めぐみ氏:人事担当執行役員の3期目を拝命した、田口めぐみです。昨年は三役体制を組織化し、優秀なメディカルアフェアーズの人材に入社いただきました。本年度は製販体制の事業拡大に向け、人事制度や人事考課などを改定する予定です。本年もよろしくお願いいたします。
秦耕平氏:事業企画担当の秦耕平です。当社は現在、ライセンス型の事業モデルから、製薬会社型事業モデルを含んだハイブリッド型事業モデルに大きく転換しているところです。引き続き、株主のみなさまにご支援いただければと思います。どうぞよろしくお願いいたします。
吹野晃一氏:研究開発担当の吹野晃一です。ご注目いただいている「テロメライシン」の食道がん第2相試験については、みなさまのご支援のおかげで、昨年10月にトップラインのデータを発表することができました。
現在は、トップラインのデータに加えてさまざまなデータを解析し、その意味を解釈しながら承認申請への準備を進めているところです。研究開発チーム一丸となって承認申請に向けて邁進していきますので、引き続きご支援をよろしくお願いいたします。
米尾哲治氏:経理・財務担当の米尾哲治です。今年で2年目となります。引き続き、みなさまに信頼いただけるようなオンコリスの土台である経理・財務部門を維持し、発展させていきます。よろしくお願いいたします。
浦田:執行役員は、以上の5名体制で取り組んでいきます。このたび吉村取締役が退任したため取締役会の中に管理部門の担当はいませんが、執行役員一丸となって吉村の不在をしっかりと補っていきたいと考えています。
マネジメントのスキルセット
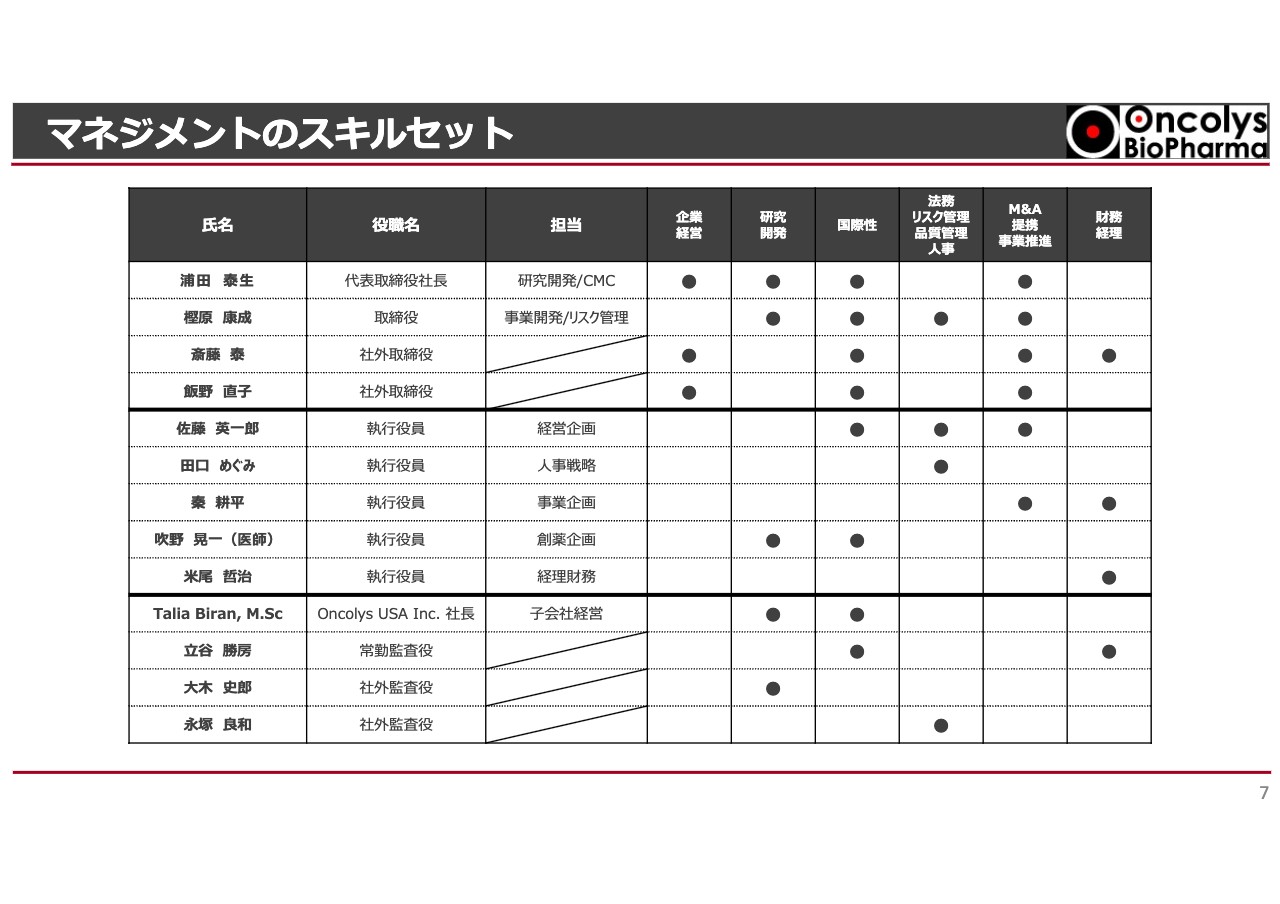
マネジメントのスキルセットです。企業経営や研究開発、法務などのさまざまな項目がありますが、非常に多様な能力を持った人材でガバナンスを行っていることが、スライドの表からおわかりになると思います。
パイプライン一覧
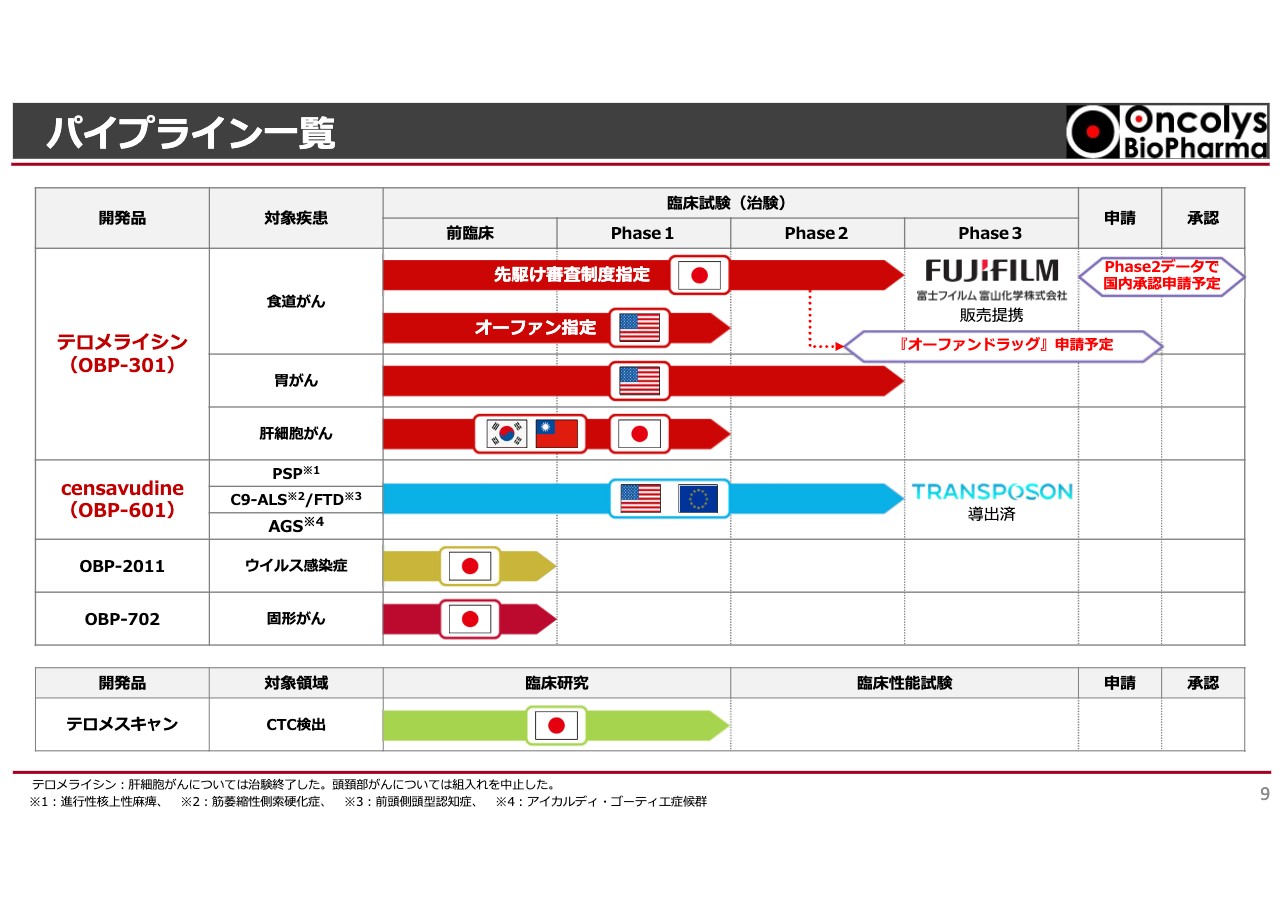
現在当社で開発しているパイプラインの一覧です。スライド上部に赤いラインで示した「テロメライシン」は、食道がん、胃がん、肝細胞がんのデータが出揃ってきています。
食道がんに対する国内の臨床試験はすでに終了し、現在はデータセットをまとめています。近いうちにPMDA(独立行政法人医薬品医療機器総合機構)と協議し、富士フイルム富山化学との製造販売体制を進めていきます。
アメリカでは食道がんに対するオーファン指定を受けており、今後どのようにアメリカでの許可を取っていくかの話し合いが続けられています。胃がんについてはメルク社と共同開発体制を組んでおり、まもなく臨床試験が開始される予定です。
スライド中央に青いラインで示した「censavudine(OBP-601)」は、Phese2の二重盲検試験が1つ終了しました。PSP(進行性核上性麻痺)という治療薬のない重い病気に対し、いよいよ結果が出てきています。
テロメライシンとは

みなさまもすでによくご存知かと思いますが、「テロメライシン」自体はウイルス製剤です。スライドの右上の写真は「バイアル」と呼ばれる薬瓶で、この中には2cc、計算上2兆個のウイルスが入っています。
ここから注射針で薬液を抜き、食道がんの場合は長いカテーテルにウイルスを詰め、内視鏡を通じてがん組織に注射してウイルスを感染させます。がん細胞だけを殺して、正常細胞には影響を与えないウイルス製剤となっています。
食道がん治療の問題
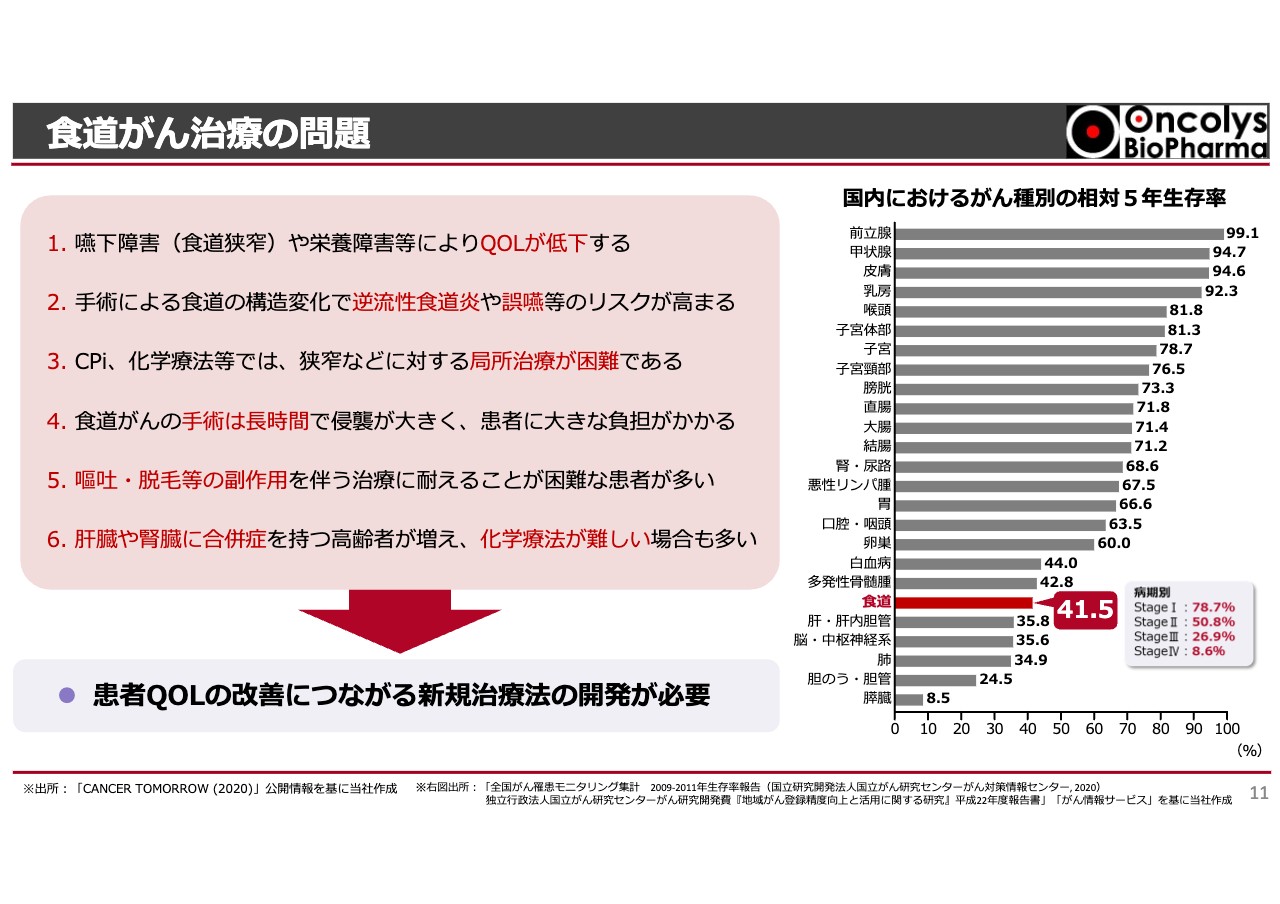
当社では、食道がんの治療法を先行開発しています。食道がんに的を絞った大きな理由は、まだアンメット・メディカル・ニーズが高いことです。
スライド右側のグラフのうち、赤いラインが食道がんを示しています。ご覧のとおり、食道がんの5年生存率はステージ1からステージ4の平均で41.5パーセント、特にステージ3以上では10パーセントから20パーセント程度と、治癒が非常に困難です。加えて、食道がんはアジアに多いがんです。
もう1つの理由は、食道がんの局所治療薬が世の中にないことです。現在、食道がんの局所治療薬を開発しているのは当社のみです。光免疫療法が食道がんに効果的である可能性もありますが、まだ開発の初期段階ですので、治しにくい病気だということは変わりません。
食道がん治療の第1選択肢は手術です。ステージ1の初期段階であれば内視鏡でも切除できる場合が多いですが、ステージ2やステージ3になると病巣が徐々に深くなります。
食道は横隔膜の上にあるため、胃がんのように臓器を切ってすぐに切除できるわけではありません。肋骨の間を切開し、心臓や肺が剝き出しのまま手術を行わなければならないため、侵襲が大きく時間もかかります。したがって、高齢者や臓器に障害のある方はとても耐えられません。
また、手術をしても、約40パーセントの方が術後に腎不全や心臓や肺の合併症を引き起こします。そして、食道がんの治療はできたものの、合併症で亡くなるという事例も多々聞いています。
第2選択肢は化学療法ですが、ご存知のとおり化学療法は副作用がかなり強い治療法です。また「ケモラジ」と呼ばれる、放射線を併用した化学療法がありますが、こちらも治癒率がそれほど高くなく、非常に苦しい治療を受けなければなりません。
このような中で、「テロメライシン」によって食道を局所的に治療することができれば、患者さまのQOL(Quality Of Life)にプラスの影響が出ると期待されています。普段の生活をしながら「テロメライシン」で食道がん治療ができるようになれば、医療的に非常に大きな意味があると考え、食道がんに的を絞って開発を進めてきました。
食道がん放射線Phase2 トップラインデータ公表
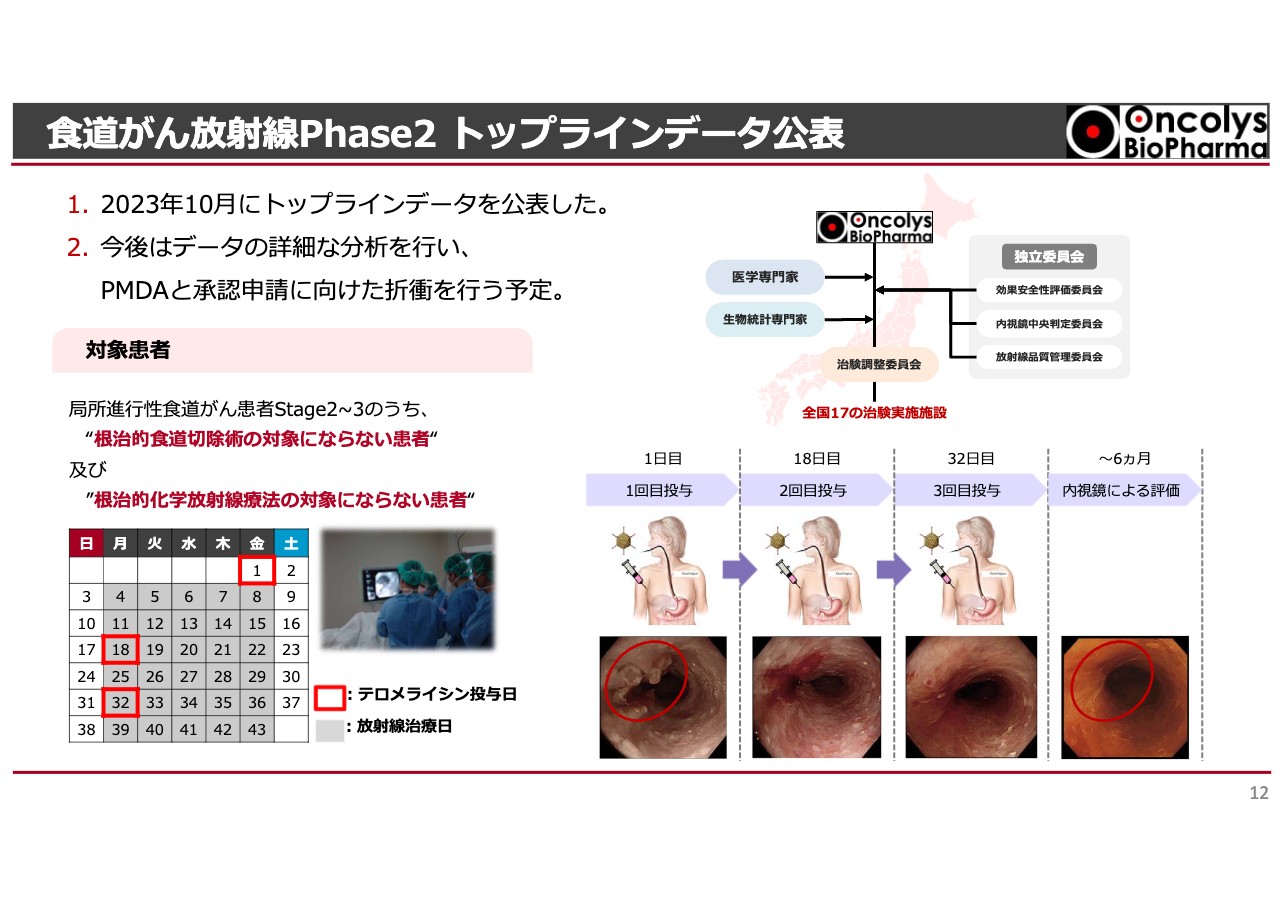
その中で、いよいよ食道がん放射線Phase2の試験結果が出ました。この試験では放射線治療を約6週間行います。毎週月曜日から金曜日まで患部に放射線を少量ずつ当てて食道がんを殺していくわけですが、治癒率はそれほど高くありません。
放射線単独治療では30パーセント未満の方になんとか効きますが、ステージ3程度になるとあまり効きません。我々はステージ2もしくはステージ3の患者さまに対し、放射線治療を受けながら、2週間に1度「テロメライシン」を内視鏡を使い食道がんの局所に注射するという臨床試験を行ってきました。
有効性評価:局所奏効率
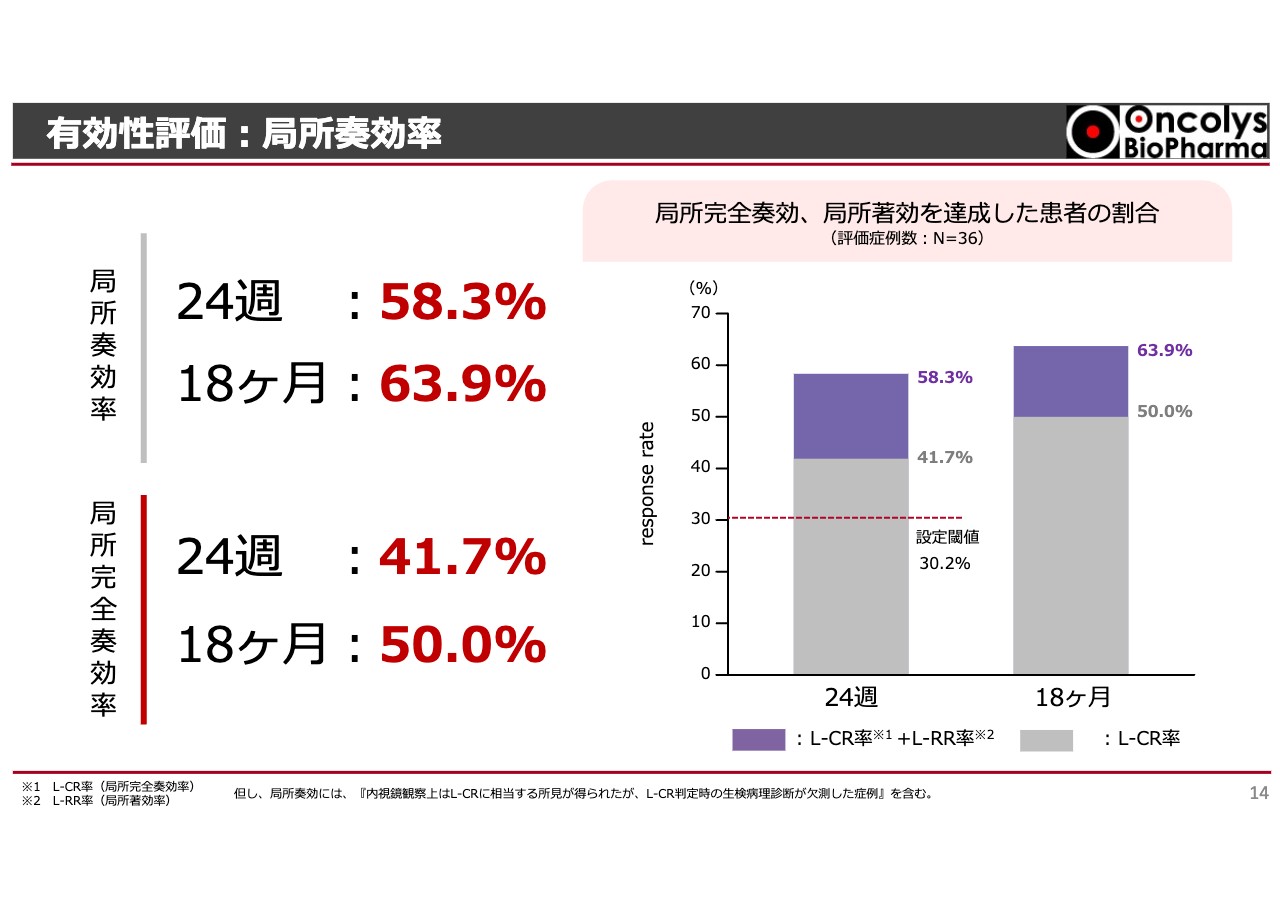
すでにIRでもお話ししたように、治験開始から24週後の局所奏効率は放射線単独治療でも30パーセントを超えるため、さらに伸ばしたいと考えていました。その結果、完全にがんが消失した方は41.7パーセントとなっています。また、がんはほぼ消失して内視鏡でも切除できる、あるいはしばらく経つと消失するという方を含めると58.3パーセントです。
加えて、彼らを18ヶ月フォローアップしたところ、41.7パーセントから50パーセントまで上がりました。時間はかかりましたが、半数の方のがんが完全に消失したということです。そのほか、もう少しで消失する方を含めると64パーセントに近く、ここまで高い数字を出した臨床結果はこれまでありません。
「テロメライシン」が食道がんに対して非常に意味のある治療法だということを、これからPMDAへ積極的に証明していきたいと考えています。
有効性評価:生存率
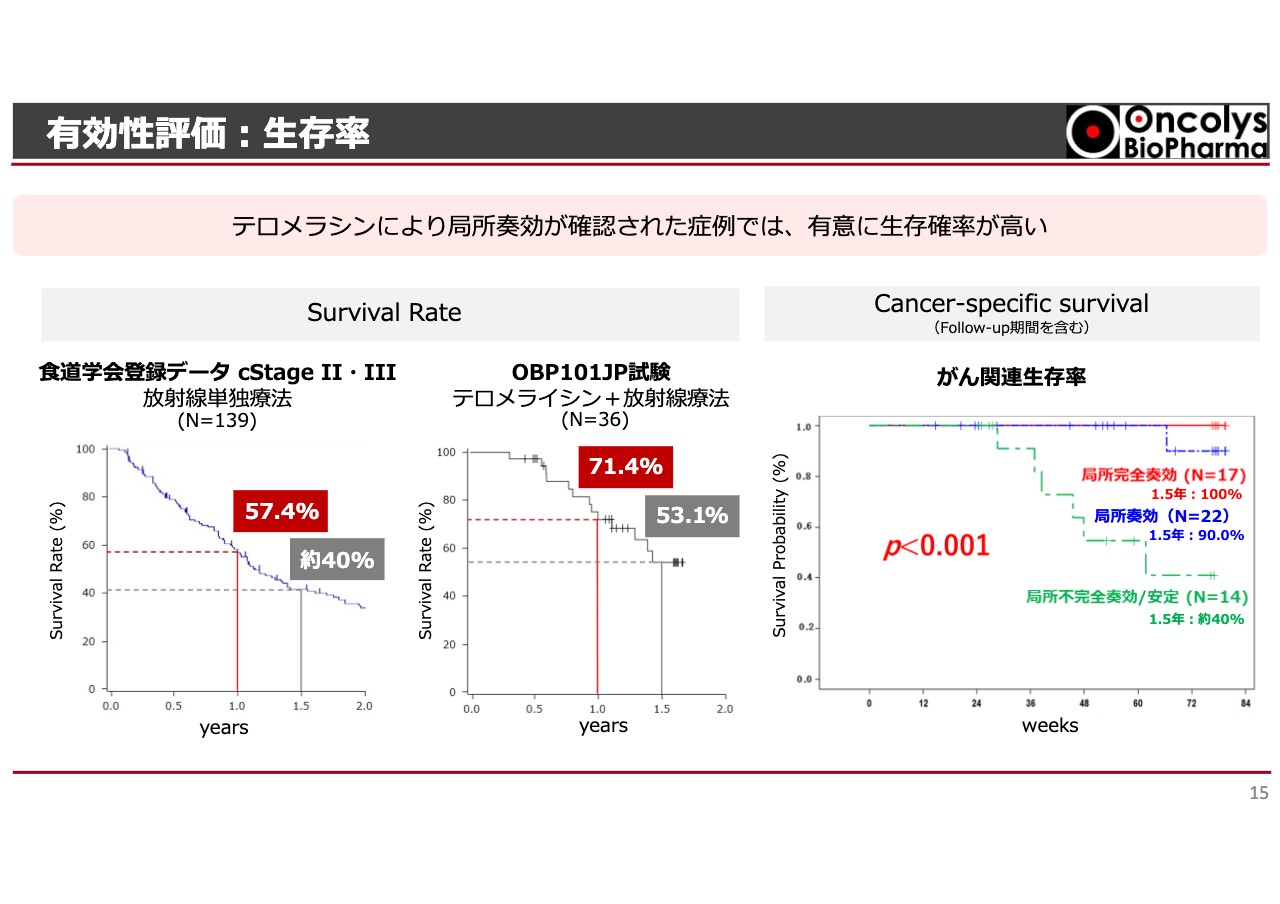
局所で奏功したものが、実際に生存率につながっているかどうかについても検討しています。
スライド左側のグラフは、今から10年ほど前に食道学会が全国の食道がん患者のデータを集めたものです。今回の試験と同じようにステージ2とステージ3の患者さまのみを取り出すと、1年後の生存率は57.4パーセント、1年半後の生存率は約40パーセントです。
今回の「テロメライシン」プラス放射線療法の結果は、1年後の生存率が71.4パーセント、1年半後の生存率が53.1パーセントと、ヒストリカルなデータよりずっと高くなっています。これによって、局所的な治療が生存率にもつながることがわかります。
さらに、この生存率には、合併症や交通事故、心不全などのがん以外の原因で亡くなった方も含まれています。そのため今回の臨床試験からは、がんが再発して亡くなった方についても調べました。結果はスライド右側のグラフの一番上のラインのとおり、完全奏功の方は1年半経過しても100パーセント生存されていました。
一方で、残念ながら局所不完全奏功の方は生存率が非常に低くなっており、局所治療は患者さまの生命予後にも関与していることが示されました。我々は、この結果を非常に意義深いものだと考えています。
食道がん放射線Phase2試験の結論

今回の試験の結論です。対象症例の75パーセントは80歳以上の高齢者であり、若い方に比べて体の弱い高齢者に対しても安全に使用できることは、主張すべき点であると考えています。また、もともと嚥下障害をお持ちの方も数多くいましたが、そのうち約7割の嚥下障害が改善したという結果も得られています。
「テロメライシン」に由来する主な副作用は、発熱や節々の痛みなど風邪に似た症状ですが、非常に多かったのは一過性のリンパ球数の低下です。しかし、試験期間中に免疫力が若干下がっても普段の生活に支障をきたすほどの自覚症状はなく、非常に軽い副作用であることが示されました。
したがって、我々は「テロメライシン」が医療現場に必要なものであると、これから強調していきたいと考えています。
胃がんにおけるメルク社との共同開発体制の構築
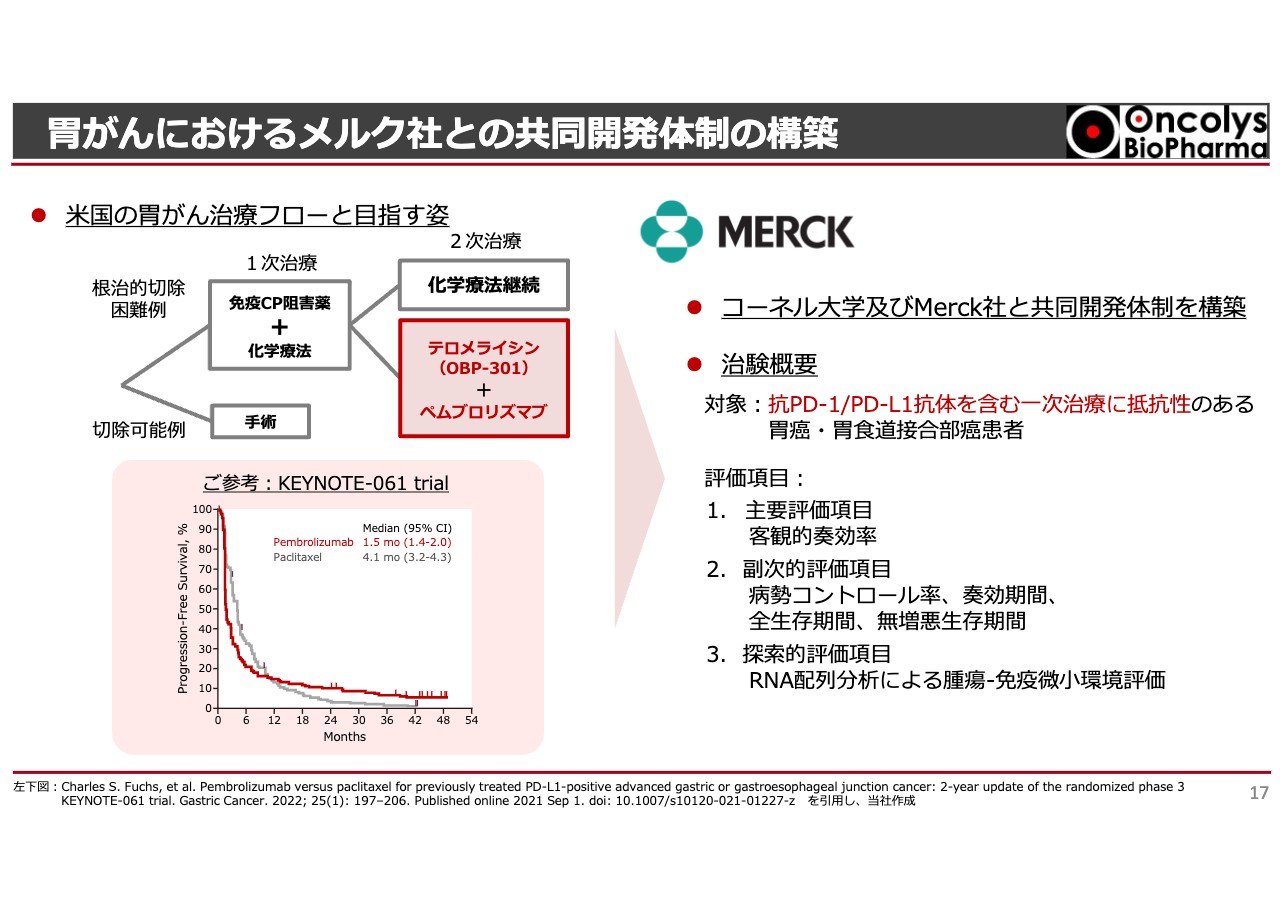
アメリカの胃がん治療についてです。こちらもすでにIRでお伝えしているように、コーネル大学が中心となり、胃がんに対してメルク社のチェックポイント阻害剤「キイトルーダ(ペムブロリズマブ)」と「テロメライシン」の併用する治験を行っています。
この治験の最大のポイントは、2次治療で「テロメライシン」を使うことです。胃がんと診断された場合、1次治療で「ペムブロリズマブ」と化学療法などを併用して予後を診るのですが、化学療法単独に比べ、「ペムブロリズマブ」を加えたほうが1年から2年後の生存率が少し高くなります。この結果により許可を受けています。
逆に言えば、この結果に表れていない8割以上の方が1次治療で失敗しているわけです。いくら効果があると言われていても、胃がんにはなかなか効きません。
1次治療が終われば2次治療に移りますが、現在は他に治療法がないため化学療法の種類を変えて治療することになります。そこで「ペムブロリズマブ」を投与し続けながら「テロメライシン」を併用してはどうかという、2次治療のポストを狙っているわけです。
胃がんの2次治療については、アメリカでもいくつかの試験が行われましたが、ほとんど効果がありませんでした。要するに、2次治療の座席が空いているということです。我々がこのようなニッチ部分を狙うことに対して、メルク社に共感いただき、ペンブロリズマブの提供と開発費折半という共同開発体制が構築できました。
このような状況を実現できた背景には、すでにコーネル大学で「ペムブロリズマブ」と「テロメライシン」のみの臨床試験が行われていたことが関係しています。その際、十数名のうち3名ほど長期間生存された方がおり、そのうち1人は胃がんがうまく治療できず、脳にも転移していました。
その方に「ペムブロリズマブ」を投与し続けたまま、胃がんの局所に「テロメライシン」を追加投与したところ、数ヶ月経過後のCTでは脳腫瘍も消失していたのです。
これにより、「テロメライシン」が「キイトルーダ」単独よりも全身の免疫を活性化させたというエビデンスがコーネル大学から公表され、2次治療で使えるのではないかということで開発プロジェクトが立ち上がりました。
我々もこの結果を非常に楽しみにしており、臨床試験の早期開始を望んでいます。結果が良ければ、大規模な臨床試験をメルク社に依頼したいと考えています。
「ペムブロリズマブ」も、あと数年でパテントが消えると言われています。ただし、メルク社はすでに相当数のパテントを出しており、基本的に、特許は消えても新しい治療法をどんどん開発することで特許期間を延ばしています。
したがって、この2次治療が実現できれば、メルク社も「キイトルーダ」を長期間マーケットで販売できますので、彼らもこの結果には大きく期待しているのではないかと思います。以上が「テロメライシン」の開発状況です。
日本での臨床試験結果をまとめ、「テロメライシン」が順調に製造できるようになれば、なんとか年内の承認申請を目指せるのではないかと考えてがんばっています。
ウイルス製造開発について
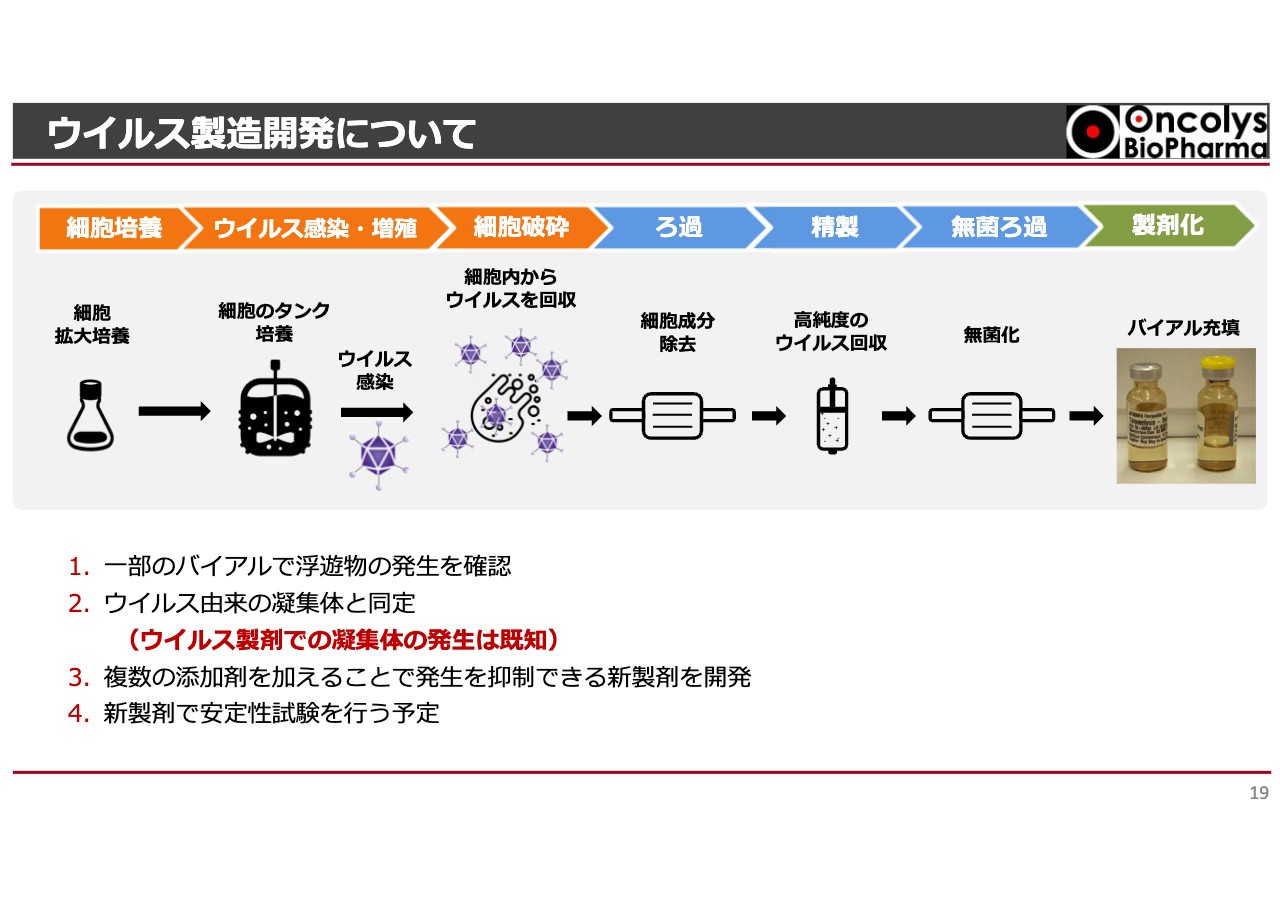
振津尚夫氏:CMC企画部の振津です。私からは「テロメライシン」製造の現状についてご報告します。「テロメライシン」製剤は、ウイルスを感染させる細胞培養から始まり、ウイルスを感染・増殖させ、細胞破砕によって取り出します。
余分な細胞成分を除去してウイルスを高純度で回収するために精製し、最終的には注射剤にするべく無菌ろ過した上で製剤化しています。これらすべての工程をベルギーのヘノジェン社に委託しており、現時点で商業生産と同一スケール、同一製造ラインを使って製造を完了しています。
その評価をしている中で、一部のバイアルで浮遊物の発生が確認されました。この浮遊物について神戸リサーチラボで分析を行った結果、ウイルス由来の凝集体であると確認が取れています。
ちなみに、ウイルス製剤での凝集体の発生は文献等ですでに既知のものです。その後も検討を進め、複数の添加剤を加えることで、凝集体の発生を抑制できる新製剤を開発しました。
一部の添加剤を加える工程は最終工程で行われるため、細胞培養から無菌ろ過の工程に影響はありません。現在は、この新製剤で安定試験を行うべく、準備を進めているところです。
また、新製剤となるため、品質管理の方法も一部追加が必要になります。その新製剤の分析方法についても、神戸研究所ならびに分析委託先であるユーロフィン社で、バリデーションに向けた準備を進めているところです。
浦田:今お話ししたように、商用製造に向けて課題は当然出てきますが、この凝集体というものを乗り越える方法が見つかりましたので、また次のアクセルを踏んで年内にすべての情報を取れるように努力していきます。
国内販売パートナーとの提携
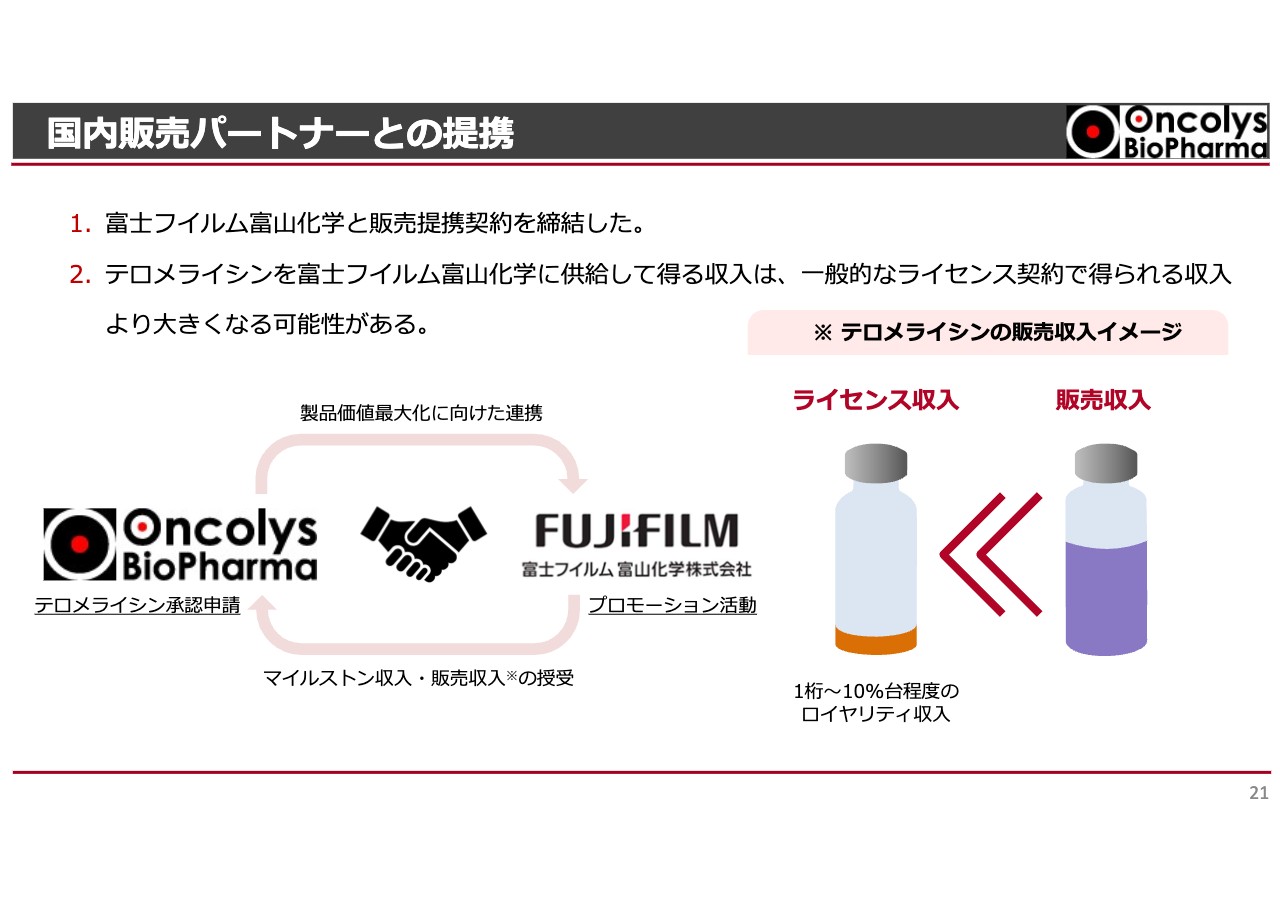
すでに何度かお話ししましたが、富士フイルム富山化学と「テロメライシン」の販売契約を締結しています。
当社にはまだセールスフォースがありません。独自の営業部門を揃える方法も考えられましたが、スタート段階ではどこかの会社と手を組むのが一番いいだろうということで、さまざまな条件を吟味した結果、富士フイルム富山化学一社に限定しました。
仮に、販売提携ではなくライセンスアウトしていた場合は、マイルストーン等が入ってきます。当社にとって悪い話ではありませんが、もう少し長期的に考えると、ライセンス収入はスライドに記載のとおり、総売上のだいたい8パーセントほどです。
一方で今回のような販売提携では、当社が富士フイルム富山化学に経費を支払って、販売をお願いします。裏返せば、残りはすべて我々の収入となるわけです。
将来に向けた実入りが大きいという意味で、富士フイルム富山化学との提携を選んだということです。
商⽤製造法の確⽴(流通)
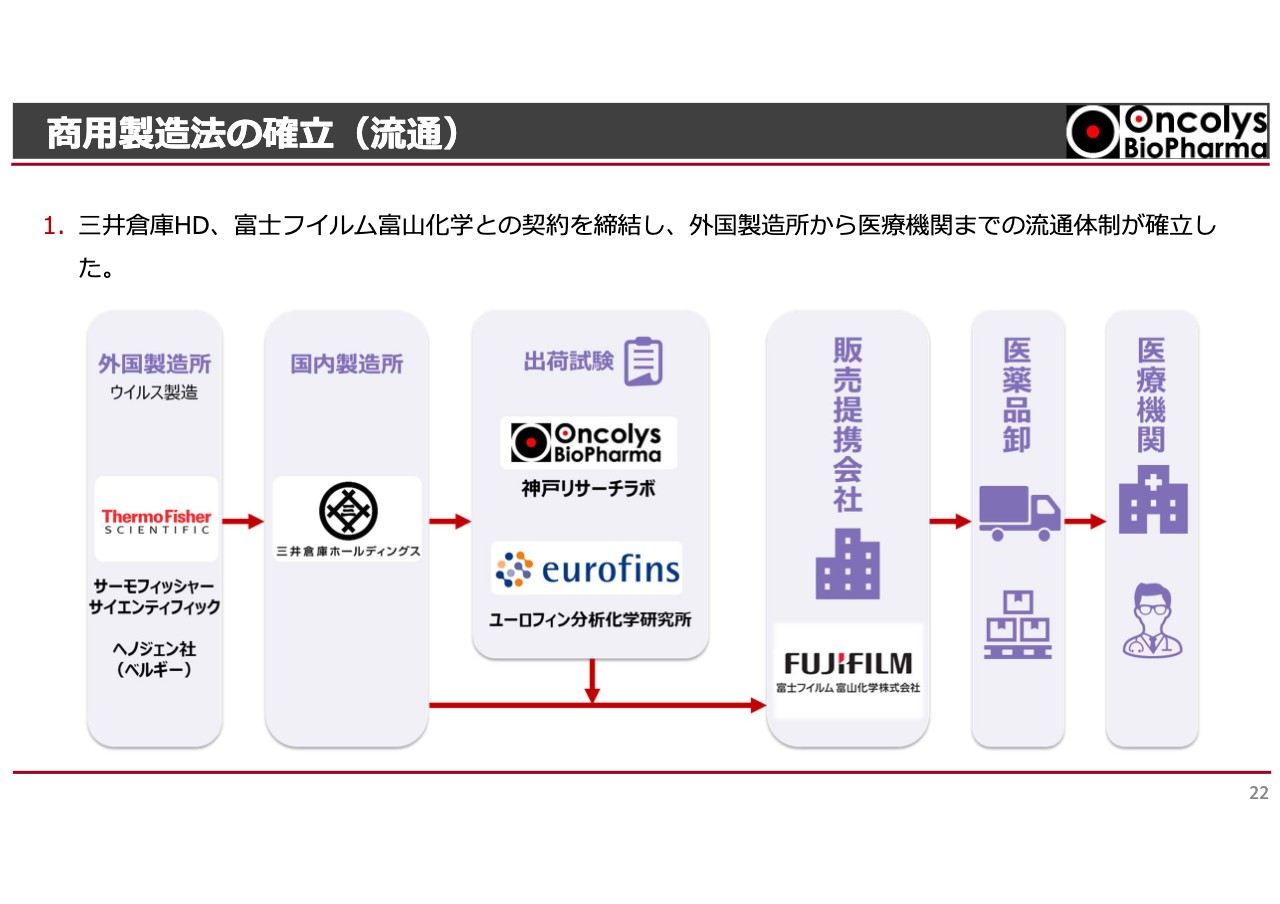
これにより、いわゆる販売の流通サプライチェーンがおおむね完成しました。実際にウイルスの原料を作るのは、スライド一番左に記載したサーモフィッシャーサイエンティフィックになります。先ほどからお話ししているヘノジェン社は、サーモフィッシャーサイエンティフィックに買収されており、こちらは世界的な医療原料や医療機器のメーカーです。
ここでウイルスを作って、ベルギーにある三井倉庫が倉庫から日本国内まで移送し、ウイルスの箱詰めを行います。日本のマーケットに出すための箱詰めで、国内製造するということになっています。その後、ユーロフィン分析科学研究所という京都の検査会社で出荷のための検査を行います。
問題がなければ、所有権は富士フイルム富山化学に移り、営業活動を行っていたただきます。この業界の流れとして医薬品卸を経ることが習わしになっており、そこだけが最終的にまだ発表できない状況です。
おそらく、富士フイルム富山化学が利用している医薬品卸企業を経ることになると思います。その後、医療機関にデリバリーされて患者さまに使っていただけるようになっています。このようなデリバリーシステムの完成が近づいてきました。
製造販売体制の確立
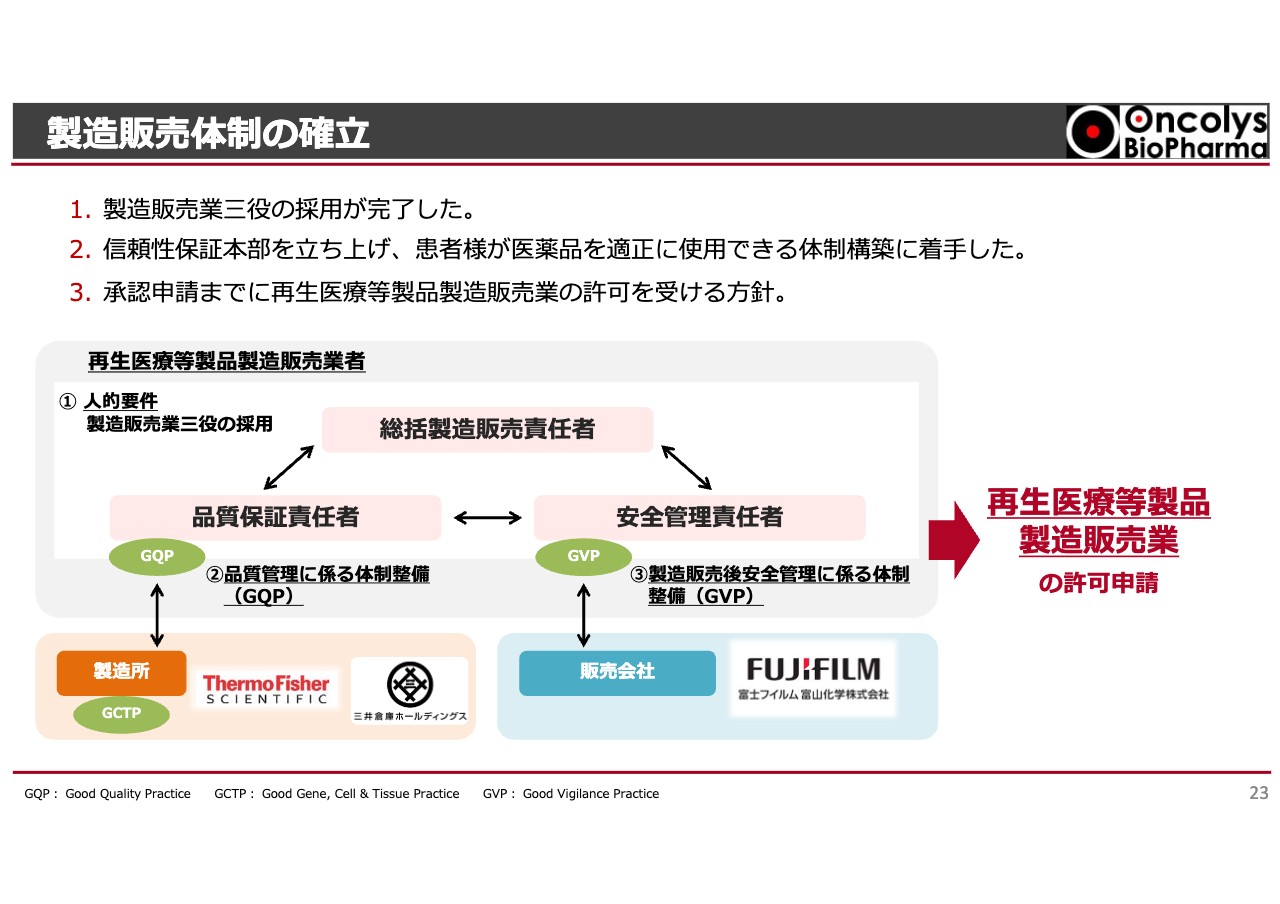
我々にとって、もう1つの大きな課題であった製造販売体制についてです。総括責任者の総責、品質保証責任者の品責、安全管理責任者の安責の三位一体となり、今後「テロメライシン」の品質や、臨床現場における安全性を管理していくGQP体制および臨床現場で安全に使われているかを監視するGVP体制を構築します。
実際には、国内製造所と海外における原料の製造所でしっかりと製造できるかをチェックするGCTP体制が作られることと、富士フイルム富山化学が販売を行うということで、当社も近い将来、再生医療等製品の製造販売業の許可申請を行う予定です。
現在は、SOP(手順書)をはじめとした書類をたくさん揃える必要があるため、その作業に専念しています。年内にはしっかり稼働するところまで持っていきたいと考えています。
神経変性疾患治療薬としての開発着眼点
「OBP-601(censavudine)」についてです。こちらはもともと抗HIV治療用の飲み薬として、2010年末に大手製薬メーカーBristol Myers Squibb(BMS)にライセンスアウトしました。
2014年にLate Phase2が終わった際には非常によい結果が出ましたが、BMS社は小野薬品工業と一緒に動いているオプジーボに全資源を投下する判断をした時期だったため「もうHIVは手がけない」とライセンスを切られてしまいました。その後ライセンス先を探す中で、大変興味深い考え方を持ったグループに出会うことができました。
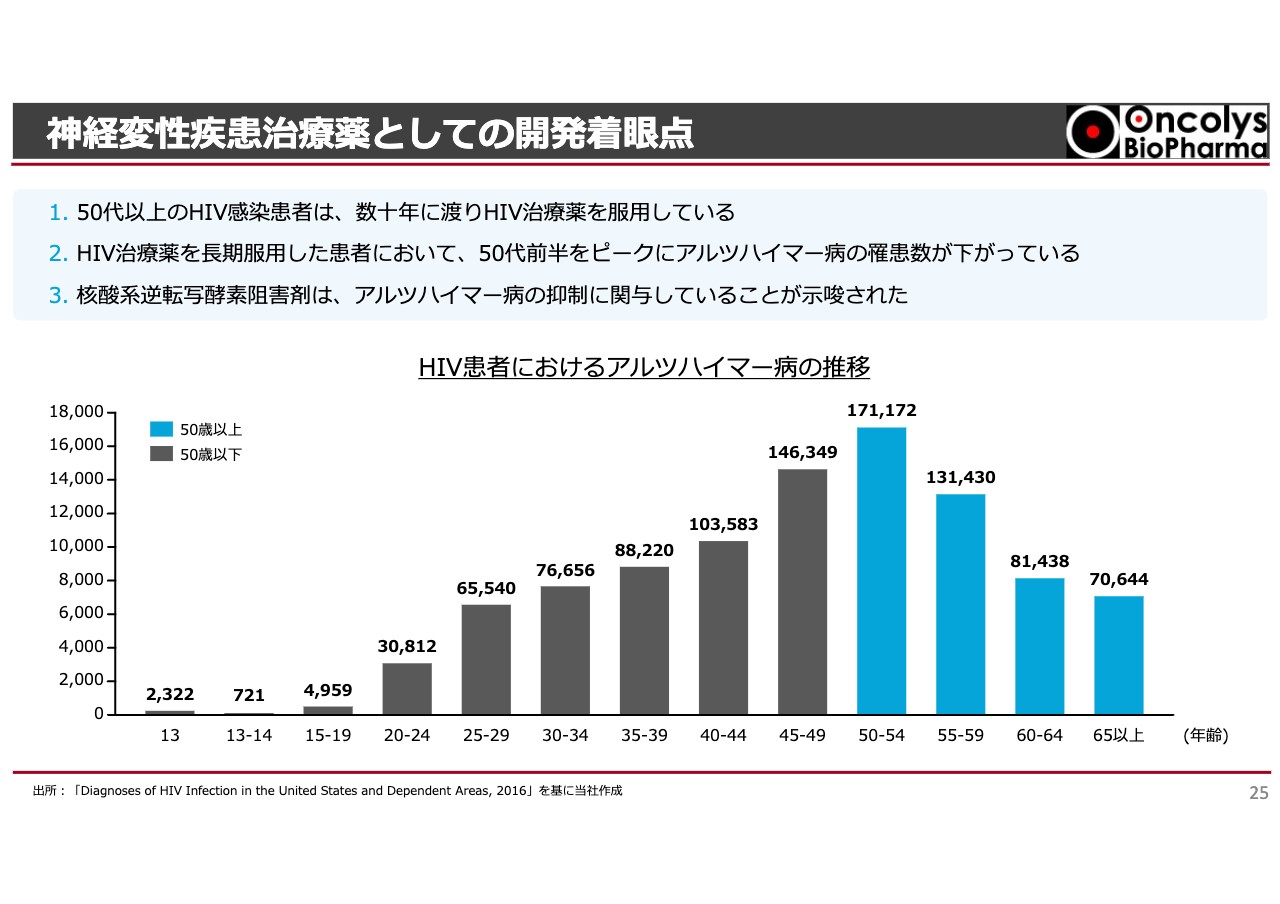
すでに何度もお伝えしていますが、HIVに感染して治療を続けている方は世界で何百万人もいます。その中で、彼らのアルツハイマー病への罹患率を統計的に示したデータがあります。
スライドのグラフには30代、40代、50代、60代、60以上、65以上と数字が出ていますが、50代や60代の方は若い頃にHIVに感染し、抗HIV薬が完成したのは1970年代後半ですので、30年近くが経っています。その間に抗HIV薬を飲んでいる方のアルツハイマー病罹患率が、低いことがわかってきました。
この理由についてはいろいろな研究結果がありますが、飲んでいる薬の中にアルツハイマーにならない何かがあるのではないかという結論に達しました。そこでニューヨークのブラウン大学において、どの抗HIV薬がアルツハイマー病に効果があるのかという研究が始まり、その中に当社の「OBP-601」が入ったのです。
censavudine(OBP-601)の新規メカニズム
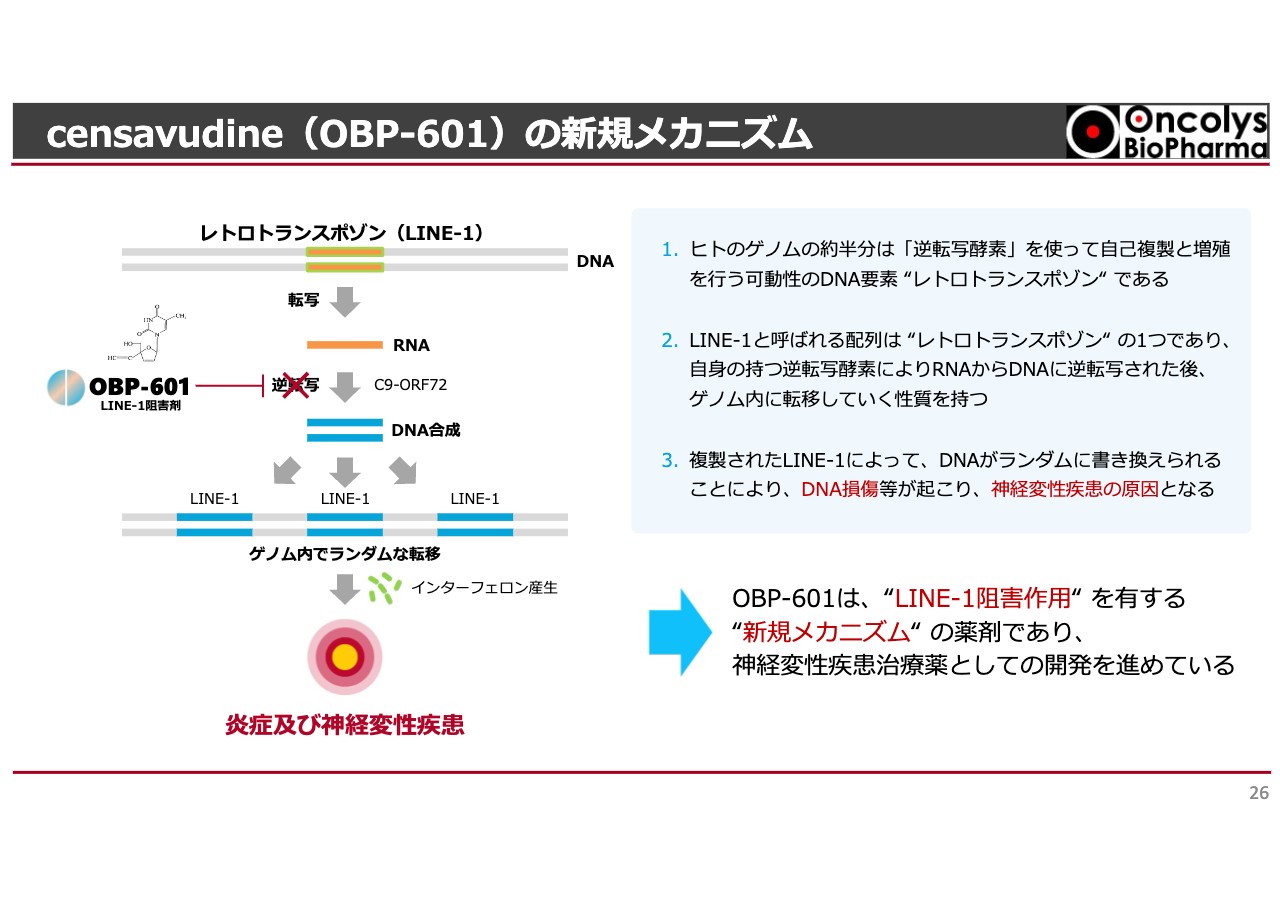
スライド左上、二本線の一番上に「レトロトランスポゾン」と記載されていますが、これは二重螺旋構造の遺伝子です。この遺伝子の中に、役割がわかっていないものが約40パーセントもあります。この遺伝子の中の1つのかたちが「レトロトランスポゾン」と呼ばれているものです。
ゲノムは逆転写を含めたトランスポーズで、どこから来たのかわからない遺伝子が入っているということですが、人間はもともとこちらを持っています。人類が誕生してから、エイズウイルスのようなものにずっと感染しながら今日に至るわけです。
エイズウイルスに感染した方は、なぜ抗HIV薬を飲む必要があるかと言うと、エイズウイルスの遺伝子がゲノムに入ってしまったためです。薬を飲んだら血液中からウイルスは消えますが、一度でも感染してしまうと、血液の中で繰り返しエイズウイルスが作られます。
これが「レトロトランスポゾン」で、我々が太古の昔、陸上に上がった頃に感染した形跡かもしれません。「レトロトランスポゾン」が我々の体内でRNAの読み取りを行い、DNAに構成されます。これをつかさどるのが「LINE-1」と呼ばれる逆転写酵素です。
DNAになると、我々のゲノムにランダムに入ってしまいます。この現象があまりにも多いと炎症性の神経変性が起こりますが、この中の悪いカスケードを「OBP-601」が強力にブロックすることがわかりました。「LINE-1」と呼んでいる酵素の阻害作用が非常に強いということで、我々に声がかかったのです。
LINE-1への活性
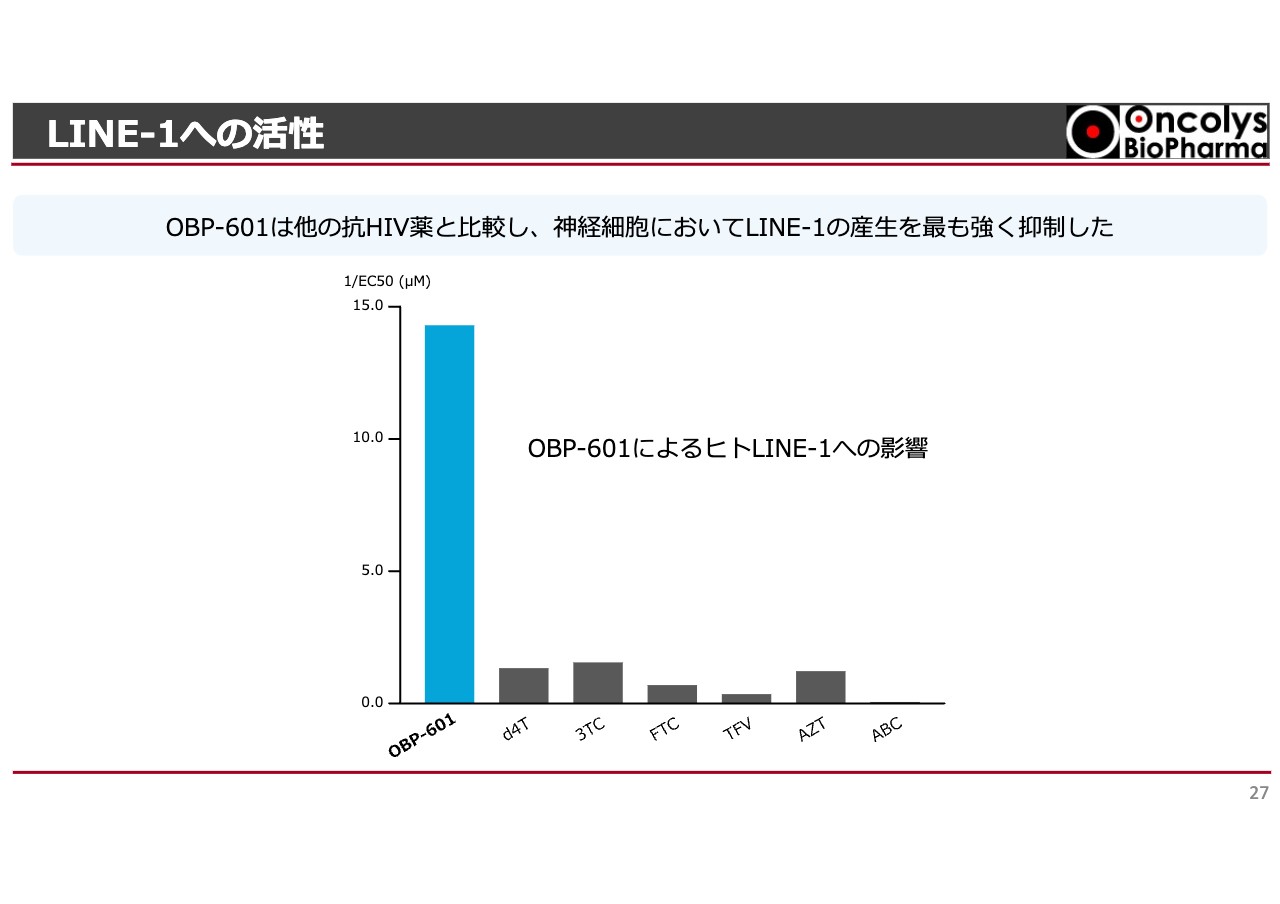
LINE-1への活性を見ています。この表の他の薬はすでにジェネリックになっており、長期間使われている抗HIV薬です。
活性が強いほうが高いですが、「OBP-601」は他の薬に比べると10倍以上も活性が強く、なおかつ他の薬よりも脳内への移行性が高いため、脳内が変性を起こす神経変性疾患にはより強く効くことがわかってきました。
ライセンス契約概要

そして、この考え方を実現させようと作られたのがTransposon社です。当社は2020年に、Transposon社と「OBP-601」のライセンス契約を締結しました。全世界の権利を渡しており、契約のマイルストーンの総額が現在の価値だと450億円以上あります。さらに、追加で販売ロイヤリティが入ってくる契約となっています。
この開発はすべてTransposon社が自分たちの資金で行うため、アメリカで資金を調達して「OBP-601」の治験を行っています。
開発進捗
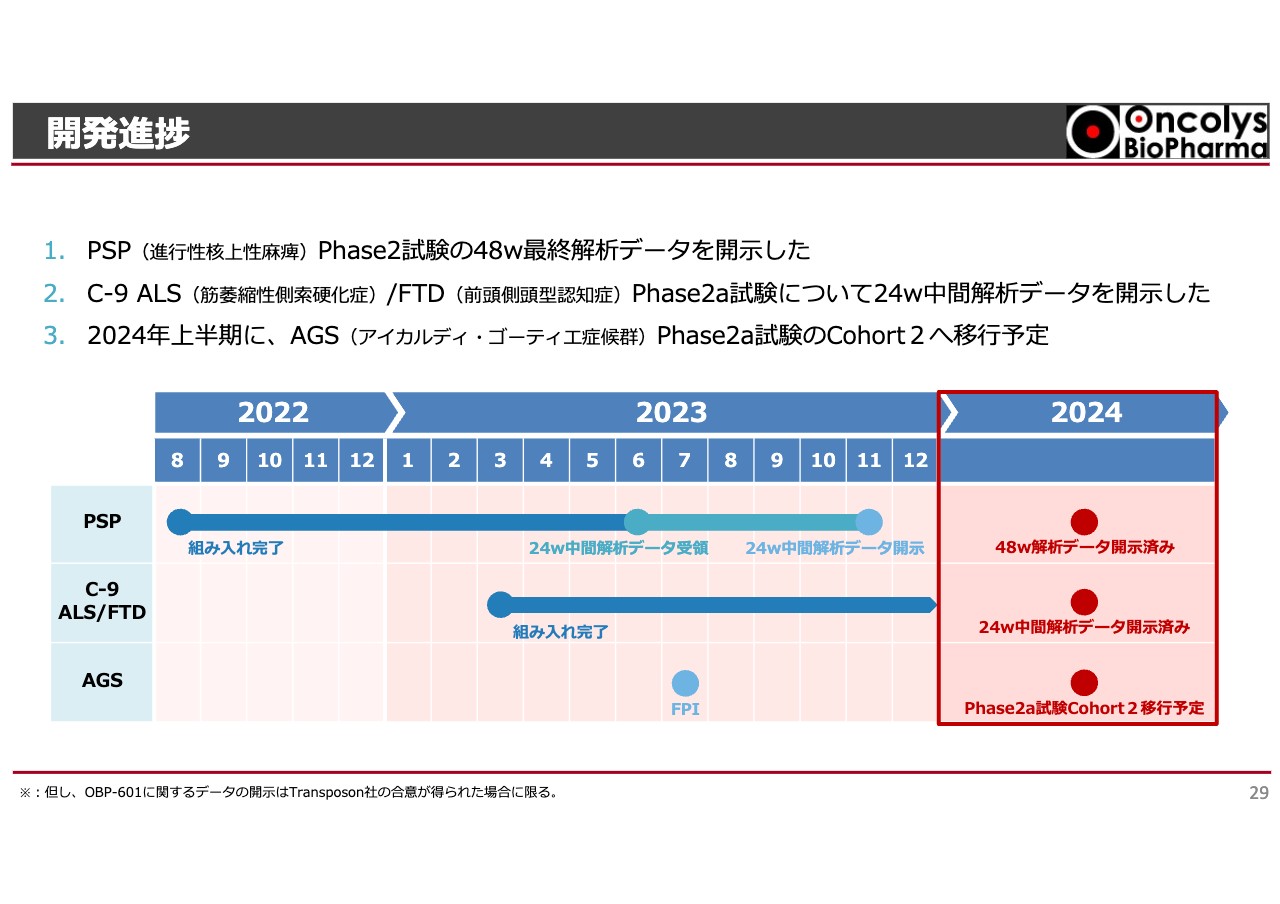
現在は、PSP、ホーキング博士が罹患した全身の筋肉が衰えるALS、映画俳優のブルース・ウィリスが罹患したと言われているFTD(前頭側頭型認知症)に対する試験を行っています。
アルツハイマー病は病気の原因自体は少し違うものの、よく似た症状を示す病気です。そのため、このような病気・疾患に対して二重盲検を行ったPhase2の臨床試験が進められてきました。
スライドの表のうち、一番上のPSPはすでに最終結果が出ています。ALSとFTDについても組み入れが終わり、年内にも中間あるいは最終結果が出る状況になっています。
PSP(進⾏性核上性⿇痺)Phase2a トップラインデータ取得

3月上旬に、ポルトガルのリスボンでアルツハイマー・パーキンソン病学会が開催され、今回のPSP(進行性核上性麻痺)臨床試験Phase2の二重盲検試験の結果が発表されました。
この病気の治療薬はありません。体の震えが起こる部分はパーキンソン病によく似ていますが、原因が異なる上、歩いていてつまずいたり認知機能が悪くなったりなどのいろいろな症状が出てきます。日本にも、数千人から1万人の患者がいると言われています。
今回はPhase2ですので、病気に対する「OBP-601」の安全性に主眼を置いている一方で、当然有効性も見ています。その結果をご説明します。二重盲検のため、医師も患者がどの薬を投与されているかわかりません。
この試験では、効き目のないプラセボを6ヶ月投与した方、毎日1日1回100ミリの「OBP-601」を6ヶ月投与した方、200ミリを1日1回6ヶ月投与した方、最大投与量の400ミリを1日1回6ヶ月間投与した方に分かれます。
そして6ヶ月後はすべての症例に対し、今度は二重盲検ではなく「OBP-601」の最大投与量400ミリをずっと投与するプログラムで、これが中間解析の結果になっています。
NfLCSF 変化量(24w)
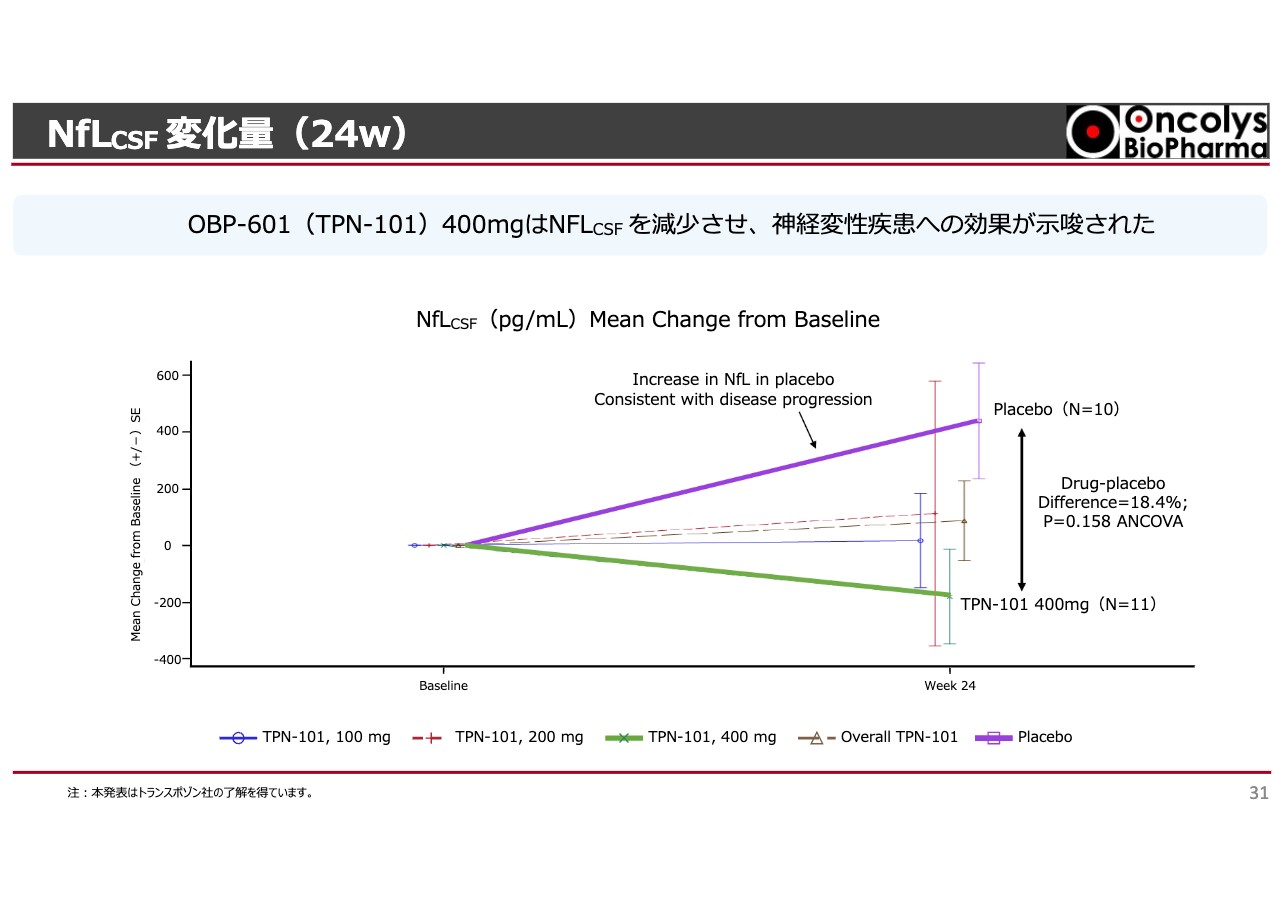
スライドに記載の「TPN-101」とは「OBP-601」のことです。少し難しい話ですが、しばらくお付き合いください。グラフは、6ヶ月後の中間結果を示しています。
「NfL」というニューロフィラメントライトチェーンに対し、我々の脳にある神経が変性性の変化をすると、どんどん溶けていきます。溶けた1つのバイオマーカーがNfLで、普通は血液中で測ります。
「CSF」とは脳脊髄液のことです。いわゆる脳のシグナルを直接見ることのできる液で、脊髄から採ります。背骨の背中側に針を刺し、液を少しだけ採るという非常に進取性の高い採集方法です。日本ではそのような試験はできないため、こちらは欧米で行われた試験のデータとなっています。
紫色の線はプラセボの結果です。約10名ずつ行っていますが、ニューロフィラメントが脊髄液中にどんどん出てくるということは、脳の中で神経が溶けていることを示します。そのため、このような状況が続くと神経症状が進行します。
NfLCSF 変化量(48w)
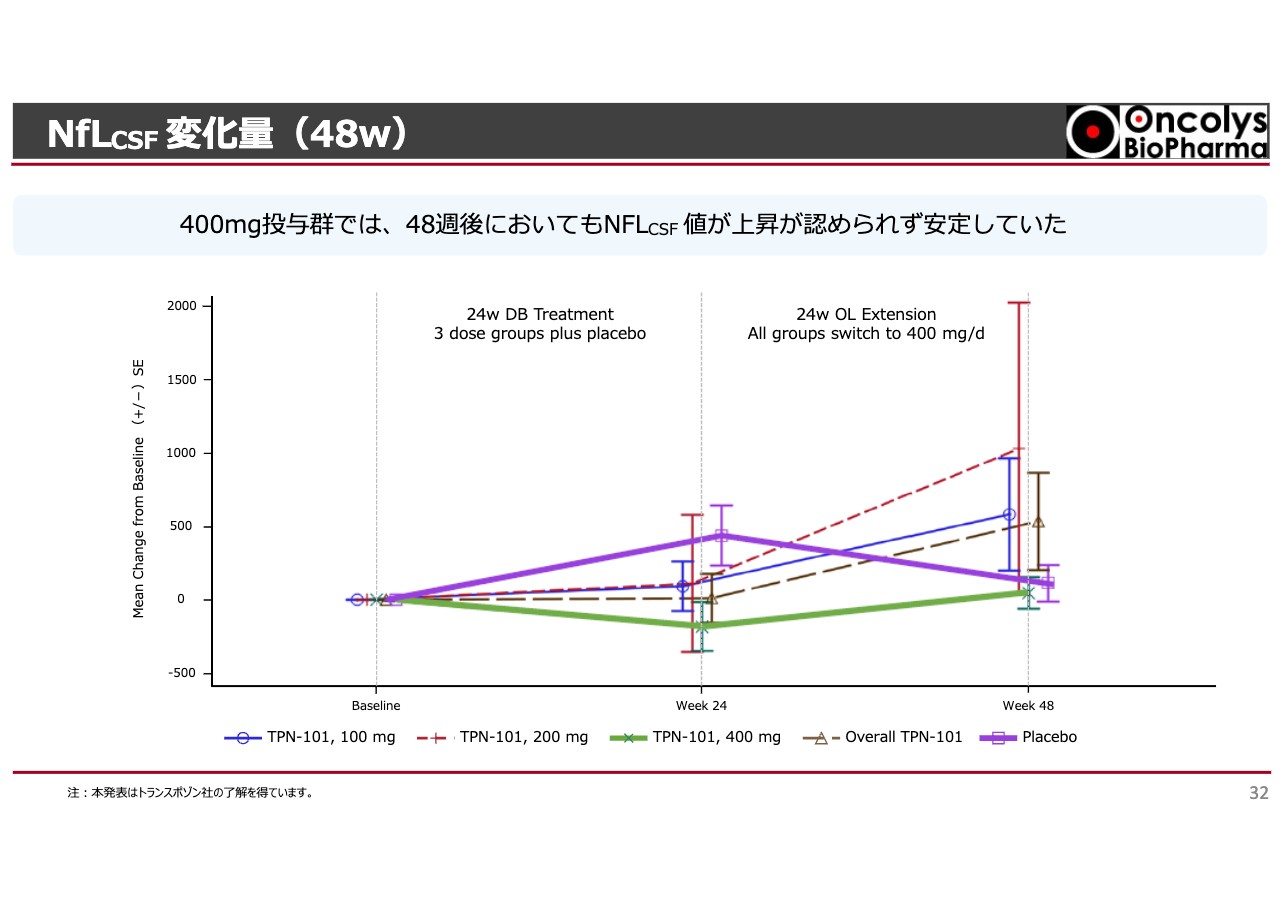
「OBP-601」を半年間投与するとNfLCSF値は少し低下しますが、ばらつきも大きいです。脳脊髄はなかなか採れず、採れたとしても少量です。測定法もバリデーションも難しいためにばらつきが大きいですが、上がっておらず若干下がっているということで、神経の障害が抑えられている結果となりました。
48週ですので1年後までフォローしますが、プラセボを投与され続けた方は6ヶ月後に「OBP-601」への投与に切り替わります。すると、どんどん上がっていたものが一度平坦化します。「OBP-601」の400ミリ群は若干上がっているように見えますが、そこからは大きく上がっていかないといった結果になりました。
IL-6CSF 変化量(24w)
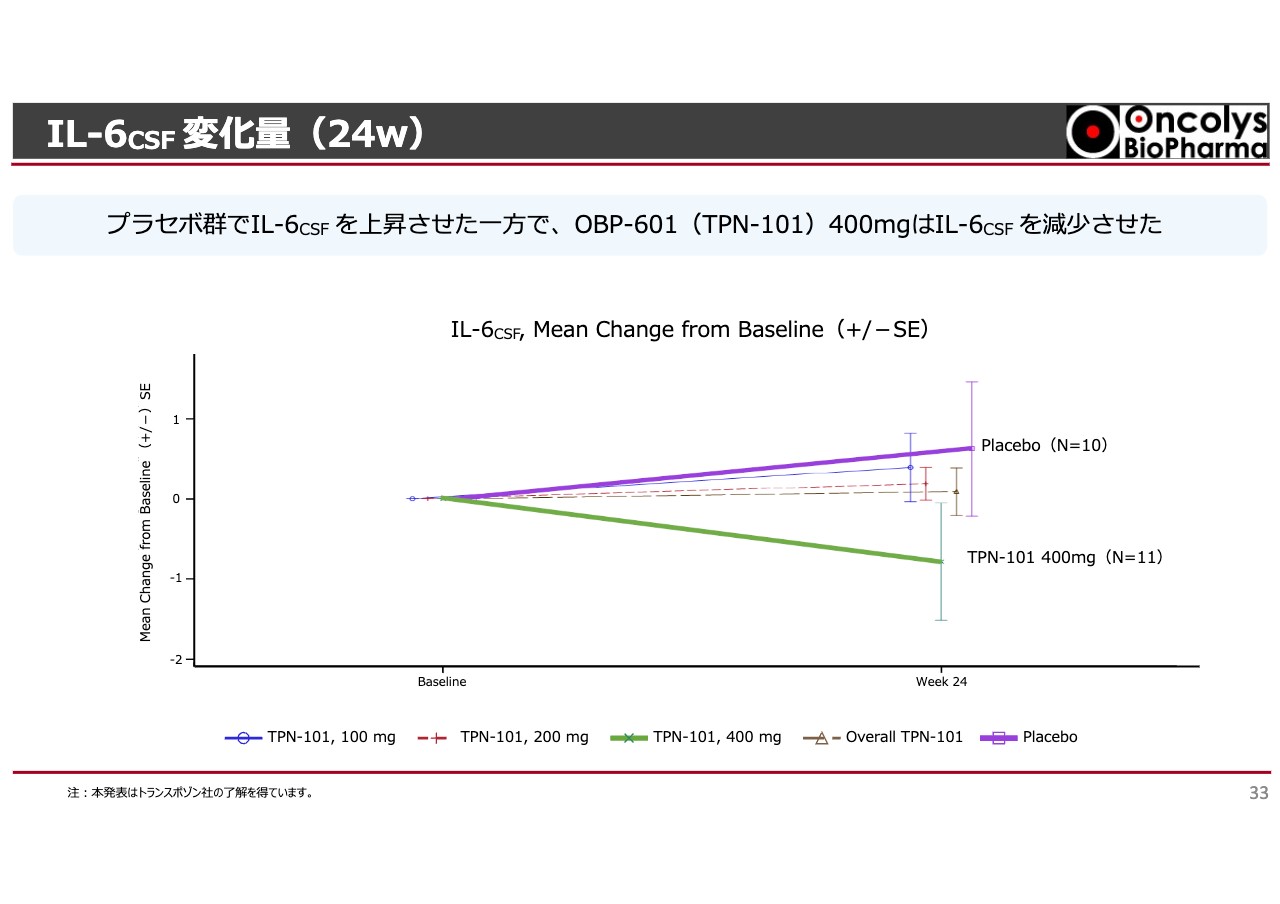
同様に、脳脊髄液中のインターロイキン-6(IL-6)という炎症に関連した、サイトカインのバイオマーカーも脊髄液中で採ります。すると、脳内で炎症が起きているために、プラセボを投与した群の値はどんどん上がっています。
しかし、「OBP-601」を投与した群は上がりませんでした。
IL-6CSF 変化量(48w)
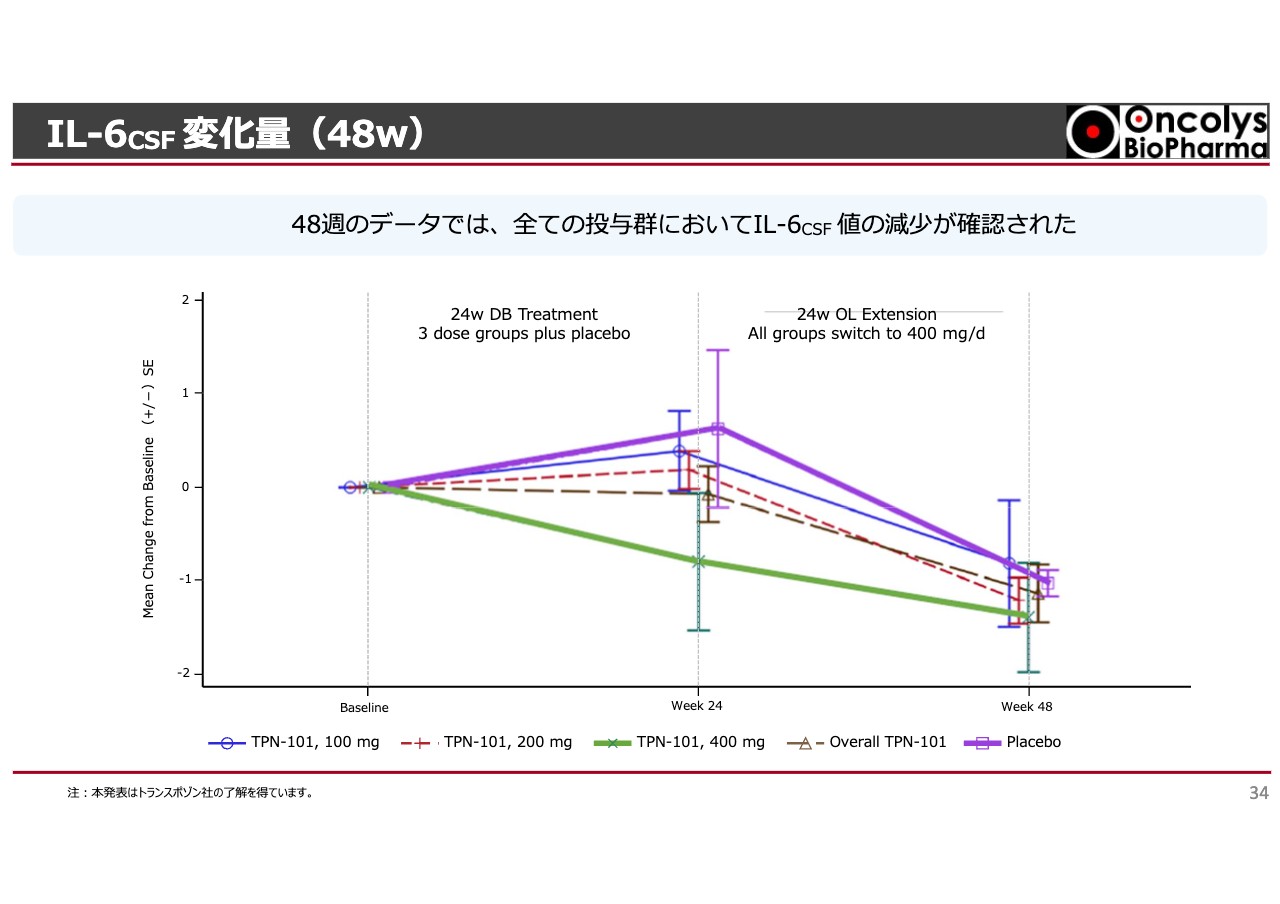
試験を1年まで延長すると、プラセボを飲んでいた方が「OBP-601」に切り替えられた途端に「IL-6」が下がります。「OBP-601」を飲んでいる方はずっと低い値が出るため、脳内の炎症も持続的に抑えているということがわかってきました。
進⾏性核上性⿇痺評価尺度(PSP Rating Scale)
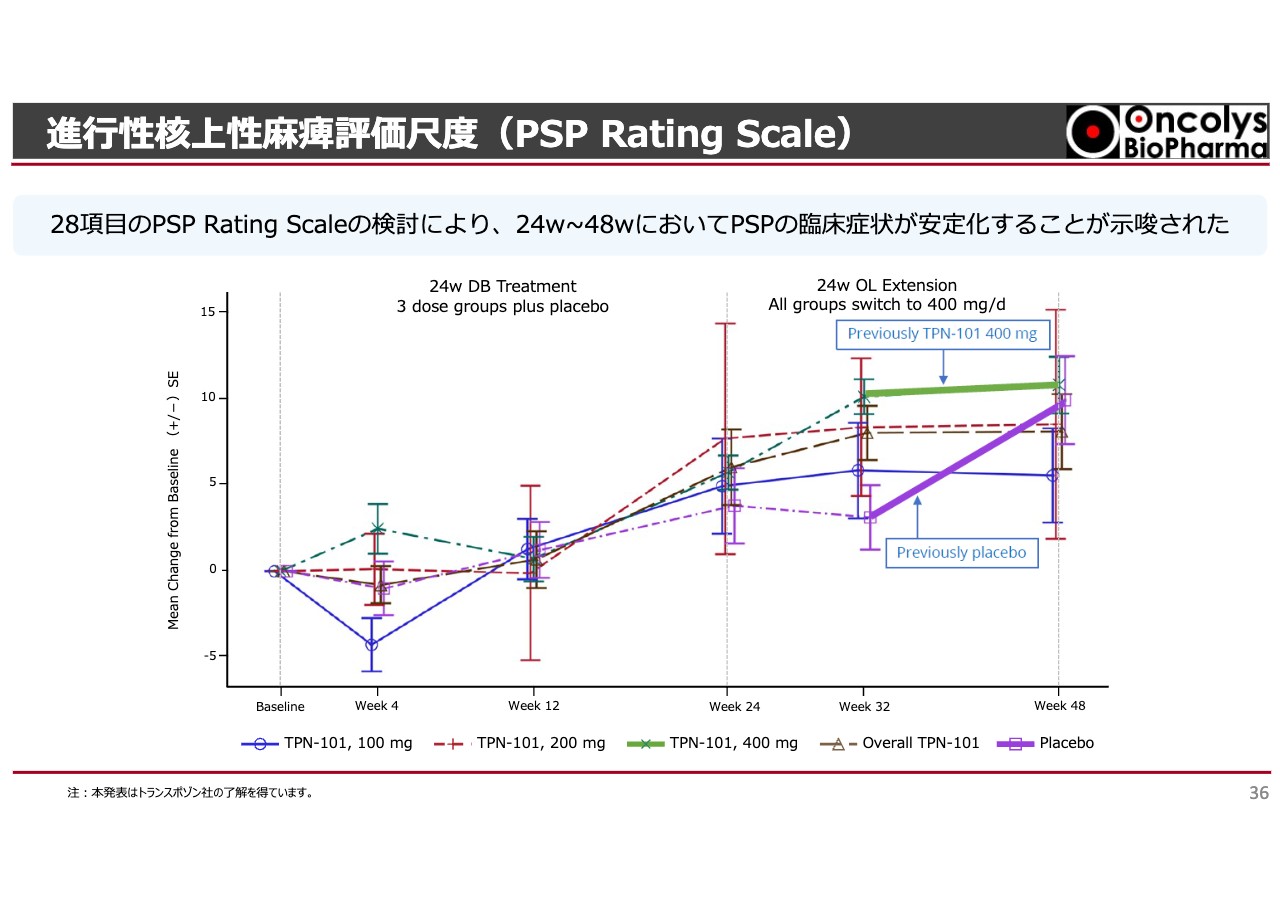
PSPのレーティングスケールとして、日常生活動作を見た結果です。お伝えしたいことは、プラセボを飲んでいた方はどんどん悪くなりましたが、「OBP-601」を投与した群は32週間後くらいから平坦化したということです。こちらは、バイオマーカーが24週までの間に変化しています。
日常生活まで影響してくるのが32週目頃で、これ以降はどんどん平坦化して病気の悪化が止まるということで、Transposon社やカリフォルニア大学の先生方は、少なくともこの病気の進展を抑制していると認めています。
これらのことから、PSPに対して非常に良い影響を与え、なおかつ副作用は軽微だったと聞いています。
PSP Phase2臨床試験の総括

PSPに対しては、「OBP-601」を1日1回飲んで治療することで、脳内のLINE-1という酵素を抑制します。加えて、レトロトランスポゾンという小さな遺伝子があちこちに飛び散らないようにすることで、脳内の炎症を抑制するだけでなく、神経が溶けることも抑制します。
このように、認知機能をはじめとするいろいろな機能を改善あるいは悪化を抑制したという結果になっています。
C9-ALS/FTD Phase2中間成績

それ以外にも、ALSやFTDの中間成績が出ています。学会では発表していないためグラフは出せませんが、脊髄中のNfLがしっかりと下がっています。FTDという病気はアルツハイマー病と非常によく似ており、分類や鑑別診断が難しいほどです。
最近、エーザイがアミロイドβの抗体をアルツハイマー病に使えると示唆しました。アミロイドβも1つのアルツハイマー病の原因ですが、次にエーザイが狙っているのはタウたんぱく質の抗体です。
タウというタンパク質は脳内に蓄積して神経を溶かしてしまうため、エーザイをはじめとした各国の製薬会社が狙っています。今回の結果を見ると、ALSやFTDの時は脳内のタウたんぱく質が上昇して病気が悪化しますが、これをしっかり抑えているという中間成績を得られています。飲み薬でこの結果が得られれば、治療は非常に楽になります。
この結果によって、抗体医薬単独ではなく、将来的にはALSやFTDあるいはPSPといった神経難病に加えてアルツハイマー病にも「OBP-601」が使えるのではないかということが、わかってきました。
すでにTransposon社に対して、学会中あるいは学会が終わってからメガファーマからいくつも問い合わせが来ており、デューデリジェンスが始まっていると聞いています。「OBP-601」が大手と組むことができれば、当社にも大変大きなメリットがあると見ています。
2024年にご期待頂きたい事項

これまでご説明した臨床データを基に我々はがんばっており、2023年度に提示したテロメライシンの販売会社との提携、アメリカでのメルクとの共同開発体制、「OBP-601」の中間成績の発表などの6項目は、いずれも達成することができました。
スライドには、2024年度にご期待いただきたい事項を記載しています。この7項目を絶対に達成したいと考えていますが、やはり大きいのは1番目の「テロメライシン」の承認申請です。臨床試験はデータが出ているため、後はPMDAと話し合いをするだけです。
しかし、製造に関して、最終成果物をウイルスの凝集ができるものに変更することが、承認申請にどれだけ大きな影響が出るかがわかりません。今後のPMDAとの話し合いにもよりますが、少なくとも、年内に承認申請できるようにスケジュールを整え、年内にはすべてデータを出して処理できる状態にしたいと考えています。
最近はPMDAが製造についていろいろと言ってくるため、それを乗り越えるだけのエビデンスを集め、年内に承認できるように最大限努力していきたいと考えています。
2番目には「テロメライシン」の商用製造の1バッチ完了を挙げています。絶対に完了させるため、先ほどお伝えしたとおりヘノジェン社のスロットを確保しました。したがって、後はがんばって作るだけです。
3番目の再生医療等製品製造販売業の許可申請も、年内にできるように三役の体制を整えたいと思っています。
4番目のサプライチェーンの始動については、三井倉庫から富士フイルム富山化学、そして卸企業がきっちり決まれば、サプライチェーンが完了します。
5番目は、メルク社と一緒に行う胃がんの試験で、これをしっかり開始させます。
下の2つはTransposon社の「OBP-601」についてです。 6番に関しては、3月に最終結果を開示したため、現時点ですでに1つは達成できました。
また、7番目のALSとFTDについては、少なくとも中間解析データをみなさまにご報告します。
我々は、これらの事項を確実に達成していきたいと考えています。
オンコリスの未来像<テロメライシン>

近未来として「テロメライシン」の承認申請ができ、承認されたらどうなるかについてご説明します。少なくとも来年中に実現すれば、世界初の腫瘍溶解アデノウイルス製剤となります。また、食道がんで使われる場合は現時点で競合がいないため、当然売上も上がっていくと考えています。
昨年も売上予測を提示していますが、我々の期待値が大きかったこともあり、少し大きめの数字を出していました。しかし、富士フイルム富山化学とディスカッションを重ねる中で「コンサバティブな売上目標にするべきだ」という結果になり、承認取得後5年間で最低48億円、最大135億円の売上目標としています。
食道がんは年間約2万5,000人の方が罹患しますが、放射線単独治療を受けるケースはそのうち5パーセントから10パーセントと言われています。その方々すべてに使われることはマーケット上ないと考えられるため、コンサバティブな数字としました。
今のところ、6週間の放射線治療の間に3回しか投与しませんが、これを4回目や5回目の投与ができるように適応拡大します。また、舌がんや首のがんなどに適応を拡大していくことで、発売後10年以内に「テロメライシン」の年間売上高100億円を目指します。
この目標に向かって営業活動をすべく、富士フイルム富山化学と話し合いが始まったところです。
売上予測の差異に関する説明

先日、成長可能性に関する資料を開示しました。去年は若干楽観的に「5年間で300億円以上売れる」と見ていましたが、プロフェッショナルである富士フイルム富山化学から「もう少しコンサバティブにマーケットを見たほうがよい」と助言をいただき、48億円から135億円の売上予測としました。
今後のシナリオ<OBP-601>
「OBP-601」については、Phase2でよい結果が出ています。アメリカではFDAと行う「End of Phase 2 会議」というものがあります。こちらは、最終臨床試験のPhase3に入ってもよいかどうかをFDAと話し合うために行われます。
FDAから「OK」もしくは「このプロトコルならOK」という承認が得られれば、彼らもPhase3を始めないわけにはいかなくなり、そこでまた資金が必要になります。その際は彼ら自身で資金集めをするオプションもありますが、PSPやALSだけではなくアルツハイマー病も対象するのであれば、そちらに対する治験の必要が出てきます。
そうなるとかなりの費用が必要ですので、スライドの4番目に記載しているようにメガファーマへのサブライセンスによる資金調達や、IPO、M&Aなどのさまざまな方法が選択肢となります。しかし、彼らが実際にどうするかは我々もわかりません。
そこで、神経変性疾患領域における近年のライセンス例をスライドに挙げています。Roche社がSerepta社から筋ジストロフィーの遺伝子治療を購入した際の総額は3,525億円、一時金は1,725億円です。
下の2つはBiogen社のライセンス例です。1つはパーキンソン病で、Denali社に総額3,225億円、一時金として1,537億円を支払っています。精神疾患に関しては、Sage社に総額4,687億円、一時金2,287億円を支払っています。
このように、総額の約50パーセントは頭金としてアメリカのベンチャー企業に支払われているのが現状です。
ご参考:中枢神経領域以外における近年の⼤型ライセンス
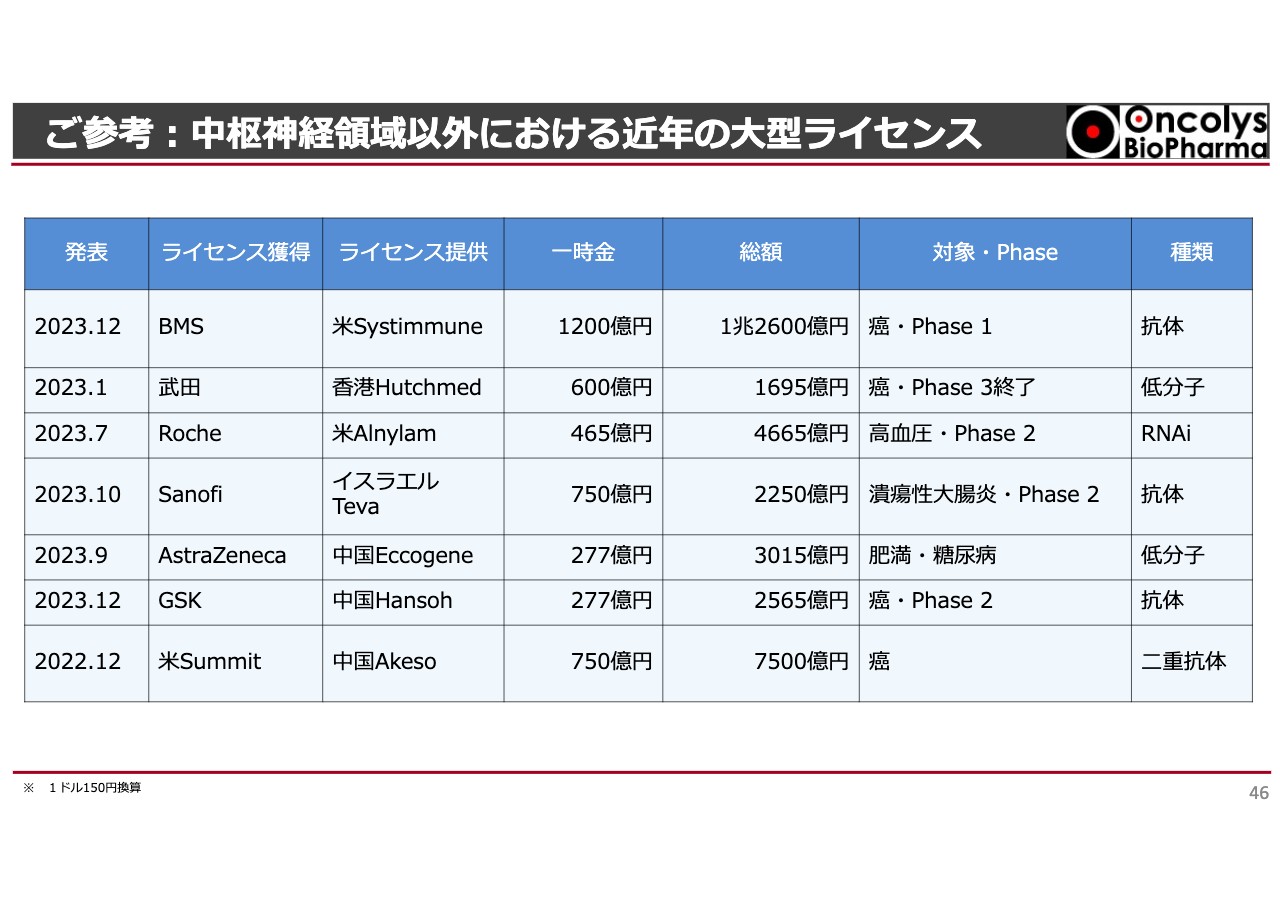
中枢神経領域以外では、抗体医薬のがん、高血圧、潰瘍性大腸炎、糖尿病などの例があります。スライドには、2022年から2023年の例を記載しています。
ライセンスを獲得する会社はBMSや武田薬品工業、Roche社などの大手製薬企業であり、ライセンスを供与する会社は、私もあまり知らない会社が多いですが、いわゆるベンチャー企業です。
がんのPhase1 のプロジェクトでも、BMSはSystimmune社に1兆2,600億円、現在の時価総額で一時金を1,200億円支払っています。それ以外にも、Phase3で高い一時金が出るのは当然かもしれませんが、Phase2でも数千億円のディールで頭金が400億円から700億円支払われています。
T社ビジネス成果のOBPへの還流を期待する
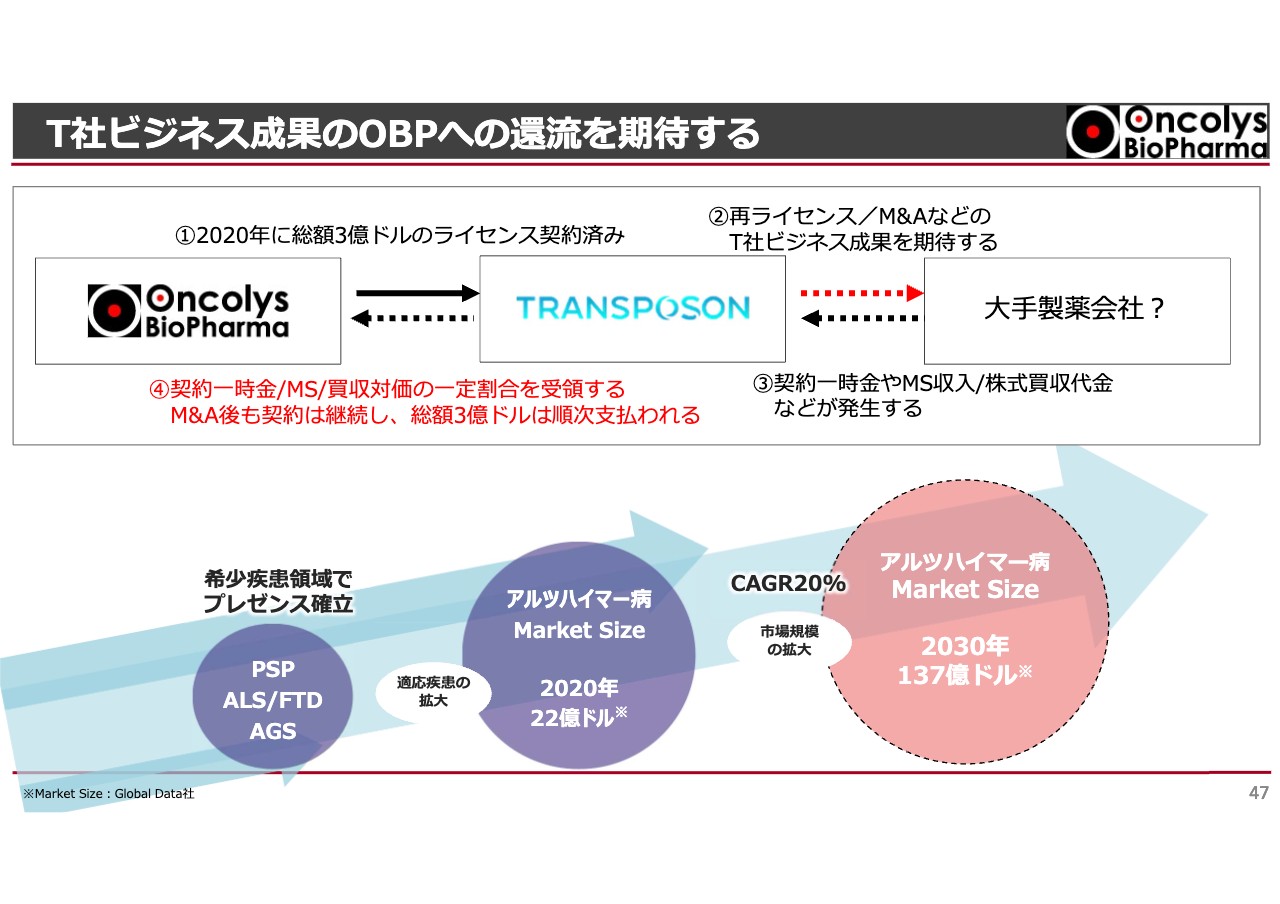
非常に値上がりしているように感じますが、Transposon社が大きなライセンスを達成し頭金やマイルストーンを受け取ることで、当社にもお金が入る仕組みになっているため期待しています。そちらに向けて我々もバックアップし、彼らがよいディールができるようにしたいと考えています。
現段階におけるバリューはオーファン領域のため、マーケットはそこまで大きくありませんが、将来的にアルツハイマー病に適応を拡大できれば非常に大きな収入になり、さらに我々はロイヤリティを受け取ることができます。
Transposon社が大きなライセンス契約を獲得できたとすると、あまり楽観はできませんが、「OBP-601」に対するマイルストーンの期待は非常に大きいです。
ビジョン

当社は、これまでライセンス契約を非常に重視してきました。ライセンス契約を結び、相手の会社にすべて開発していただくかたちで進めてきましたが、それだけでは会社の体制は強化されません。会社の存続には、製薬会社並みの体制にすることが重要だと考えています。
今後もライセンス契約を結んでいきますが、製薬会社型の事業モデルを含んだハイブリッド型バイオ企業として、これからも成長していきたいと考えています。ご清聴ありがとうございました。
質疑応答:「テロメライシン」の今後の展開と日本以外の国への販売戦略、メディカルアフェアーズの活動について

質問者:「テロメライシン」について、3点お聞きします。
製造販売業の三役の話が出ましたが、具体的に確保の目処が立っているのかを教えてください。
2点目の質問です。富士フイルム富山化学と組んだというお話ですが、今後自社だけでは戦略的に難しいと思われる、アジアなど日本以外の国をどのように考えているのでしょうか?
3点目の質問です。メディカルアフェアーズは、どのぐらいの規模で、どのようなアクションを具体的に考えているのか教えてください。
浦田: 1点目の三役について、すでに人物は決まっています。総括製造販売責任者は、某日本の製薬メーカーで何年も経験してきた経験者です。また、品質保証責任者に関しても任命しました。安全管理責任者も大手製薬メーカーの経験者で、少なくとも三役は達成できたと考えています。
スタッフをどうするかが今後の課題ではありますが、中核はできたとお考えいただければと思います。
2点目は、日本以外のアジアへの販売のお話です。少なくとも、富士フイルム富山化学は、日本国内での販売ですので、海外で販売は行いません。
食道がんは、欧米の病気というよりは、むしろアジアに患者が多いわけです。そのため、マーケットが大きい中国、あるいは、これから発展著しい東南アジアの国が、当然ターゲットになっていきます。
まだそのあたりには、手が回っていないのが実際のところですが、我々が提携している台湾のメディジェンを1つの足がかりにし、アジアの国へのライセンスや販売提携を一緒に進めていければと考えています。
特に日本で承認されれば、インドネシアやタイのような国では、ハードルを低く承認していただけると思います。患者の数が多く、新薬の開発もかなり進んでいる国ですので、そのような会社との提携は、当然視野に入っています。
しかし、まずは日本国内で許可を取ることが非常に重要ですので、海外での販売は将来的な課題だと思っています。
3点目のメディカルアフェアーズは大手外資系企業出身者を採用しました。富士フイルム富山化学のマーケティングの方々と、メディカルアフェアーズで、すでに話し合いが進められています。実際にマーケットをどうしていくか、メディカルアフェアーズとしての我々の活動と仕事の分担について、切り分けている状況です。
近いうちに、富士フイルム富山化学とキックオフミーティングをする予定で、活動が開始されています。今後の体制は、もう少し補強が必要だと思っていますが、軸はできたと考えています。
質疑応答:バイオベンチャーから製薬会社に変わる必要性とメリットについて

質問者:オンコリスバイオファーマが、バイオベンチャーから製薬会社に転換するというお話ですが、製薬会社に変わっていく必要性はあるのでしょうか? また、バイオベンチャーから製薬会社になった時のメリットは何なのでしょうか?
浦田:最後のスライドにもありましたように、ライセンスだけではなく、製薬会社の体制をとりたいと申し上げました。
1つは、中外製薬から「テロメライシン」のライセンスを切られた後に、自分たちで絶対に行っていくという固い決意のもとに考えました。また、製販体制を持つことは、世界的に見ても非常に重要なことだと考えています。
例えば、かつて我々は、欧米で売れている薬やこれから売る薬にアクセスし「オーファンドラッグ」として、日本で開発して売ろうとしましたが、「オンコリスバイオファーマは製販体制がないから駄目だ」ということで、断られました。
「オーファンドラッグ」で、非常にマーケットは小さいものの、臨床的な意義が高い薬はいくつもあります。大手製薬メーカーの力には敵いませんが、仮に将来、我々が導入する時に製販体制を持っていることは、世界的な製薬メーカーにアピールする上で、非常に重要なことだと考えており、その点でメリットがあります。
確かにお金も手間もかかるため、「そんなことをしない方がいいのではないのか」「どんどんライセンスするべきだ」という考え方も当然あると思いますが、少し違った方法もあると考えています。
質疑応答:「テロメライシン」の承認申請のスケジュール感について
質問者:「テロメライシン」の承認申請のスケジュールについては、上半期でしょうか?承認申請でマイルストーンとなる収入が発生するような契約があるのかをお聞かせください。
浦田:まず、現在我々が考えているのは、上期ではなく年内に承認申請ができるように、すべてのデータを整えて、PMDAを説得するというところに軸を置いています。
また、承認申請では、マイルストーンはありませんが、承認されると、マイルストーンを1つ達成することになります。
質疑応答:富士フイルム富山化学との提携理由と卸会社を絞る理由について
質問者:「テロメライシン」についてお聞きします。オンコリスの上位株主にはアステラス製薬があります。アステラス製薬ではなく、なぜ富士フイルム富山化学になったのでしょうか? また、「テロメライシン」の卸会社を1社に絞るのかを教えてください。
浦田:アステラス製薬にもアプローチしましたが、富士フイルム富山化学は、販売だけではなく、マイルストーンも支払っていただけるという条件のため選びました。また、卸は、我々もある程度は関与しますが、やはり富士フイルム富山化学が、一番使いやすい会社を尊重したいと思っています。
今後どうなるかは、決定していないため申し上げられませんが、おそらく「テロメライシン」は、大規模かつ多数の病院で使われる薬ではなく、中規模以上の病院で使われることになると思います。非常に限られた卸だけでスタートすることになると考えています。
質疑応答:「OBP-601」の状況について

質問者: Transposon社がEnd of Phase2会議を行った後の開発見通しを教えてください。
さらに、先ほどのスライドにもあったTransposon社が第三者にライセンスした場合、そのうちの何パーセントを御社が受け取れるのかを教えていただければと思います。
浦田:「OBP-601」のPhase3は、FDAからゴーサインが出ても、お金がなければ始まらないため、お金を調達できるのかということになります。昨年、アメリカ合衆国でも、IPOの数が減って、バイオへの投資もかなり減少しました。
今年に入り、アメリカのバイオ業界のいろいろなニュースを見ていると、ようやくまたお金が動き出したということで、資金調達も不可能ではないと思っています。ただし、Phase3となると、いろいろな病気の中の1つだけというわけにはいかず、1つの病気でも2つのPhase3をやる可能性も出てきます。そうすると、治験がたくさん走ることになります。
彼らがどの病気を選ぶかはまだわかりませんが、やはり100億円規模の資金調達をしなければいけなくなります。そうなると、自社単独で行うという手もありますが、有効性を本当に認めていただけるのであれば、ライセンスをして、大手がPhase3を行うのが、我々としてもよいと思います。
彼らも単独で行うよりは、そのほうがよいかもしれません。彼らがどの道を選ぶかは我々は口出しできないのでわからないのですが、彼らも早くPhase3を始めるべきだと考えていますので、一番お金が入ってくる方法を選ぶと思います。
End of Phase2会議も、PSPだけで行うのか、2番目のALS/FTDという病気も含めて全体で行うのかで、かなり違ってくるとは思います。Phase3が始まるのは、来年の今頃ではないかと私は予想しているのですが、実際にはわかりません。海外でさらに早く進むことも十分あり得ます。
彼らは非常にスピード感を持って行い、きちんとした結果をこれまでも出しているため、早めにスタートできることを期待しています。

また、サブライセンス収入については、先ほどもお話しましたように、例えば大手からTransposon社に頭金が入ってきたとします。その中のかなり大きなパーセンテージが我々に入ってくる契約にしています。1,000億円いくかどうかはわかりませんが、本当にそれが達成できれば、相当大きなお金が入ってくる可能性があるとご理解いただければと思います。
質疑応答:治験と承認申請に使う「テロメライシン」の同等性について
質問者:「テロメライシン」の承認申請に関連して、治験で使った「テロメライシン」と、ベルギーで作る「テロメライシン」の同等性に対しての対策や考え方を教えてください。
浦田:当然、我々も「テロメライシン」の同等性に対しては、非常に気を使っています。いろいろな品質試験があり、活性や夾雑物が入っているかどうかを調べます。これまでのいろいろなデータを集積すると、数字上は基本的に同じと言えるわけですが、最終的にまだその判断をしたわけではありません。
我々の「テロメライシン」は、中にDNAが入っているDNAウイルスです。コロナウイルスのような変異しやすいRNAウイルスとは異なります。また、「テロメライシン」は、今のところまったく変異していません。
ところが、細胞は生きていますので、ある条件によって測る時には、細胞からエクソソームなど、いろいろなタンパクが分泌されます。いくらきれいな細胞を取ってきても、それを瓶の中に入れると、また細胞がそこからいろいろなものを分泌して、中にいろいろなタンパクが出てきたり、いろいろなアミノ酸が出てきたりします。
そのため、細胞では同等性を証明するのは、非常に難しいということは我々も感じています。それと比べると、我々のウイルスは、ほとんど変わっていかないことが少なくともわかっています。したがって、大丈夫というつもりはないのですが、細胞医薬を進めているところと、我々のような、ウイルスで進めているところの違いはあると思っています。
ただ、ウイルスも、いろいろな夾雑物が入ってくるため、それをうまく取り除くかということに関しては、まだ非常に苦心しています。しかし、少なくとも原材料を作るところまでは、過去と確実に同じものができていることが証明されつつあります。
今、ご指摘のとおり、我々も決して楽観視しているわけではなく、徹底的に同等性を証明できるように努力していこうと考えています。他社も相当苦労されたと思うのですが、我々も最大限の苦労をして進めていきたいと思っています。
質疑応答:「テロメライシン」のオーファン指定を受けた後の実績について
質問者:「テロメライシン」について、アメリカで食道がんのオーファン指定を受けた後の販売実績や使用実績はありますか?
浦田:アメリカでのオーファンドラッグ申請は、基本的に日本のデータを使っています。放射線単独治療の患者への併用で、局所的に非常によく効きます。人口割合からするとアメリカは日本よりも食道がんの患者が少ないため、その意味でオーファン指定が取れたということです。
その後は、アメリカのNRGグループという大きな臨床試験グループがあり、食道がんの放射線化学療法に「テロメライシン」を上乗せすることが、本当に安全かつ有効であるかの治験を行っている最中です。
また「ペムブロリズマブ」は胃がんへの治療に加え、胃と食道の接合部のがんでも一部使われています。アメリカでも、それほど多くの実績があるわけではないことをご理解いただければと思います。
質疑応答:「テロメライシン」の小児がんへの適用について
質問者:今年配信された社長のインタビューを拝見しましたが、一部、小児がんへの言及があったと思います。現在「テロメライシン」が小児がんに適用できるのか、具体的にはどうされるのか、というところをお聞かせ願えますか?
浦田:「テロメライシン」の小児がんに対する我々の考えですが、以前は「テロメライシン」も含めた新しい遺伝子治療に取り組んでいきたいという話を申し上げました。
小児がんは、臓器の固形がんは少なく、リンパ腫や白血病のようなものが多い傾向です。肉腫といったものもありますが、そのような小児の固形がんに関しては、わりと方法論が確立されています。脳腫瘍もなくはないのですが、小児の食道がんがあるかといったらほとんどないため、「では、『テロメライシン』でやりましょう」というところまではまだ来ていません。
やはり成人での安全性や使い方というのが、本当にオーソライズされないと、なかなか小児がんにはチャレンジしにくいです。ただ、我々は昨今、成育医療センターと、いろいろな情報交換をするルートを作りました。特にテロメライシンはカルタヘナの規制があるため、遺伝子改変のDNAを持つ「テロメライシン」を臨床現場で、どのように使うかというアドバイスを受ける契約をしています。
そのような中で、小児に対して、どのような取り組みができるかということに、私は大変興味を持っていますので、今後の課題とさせていただければと思います。
浦田泰生氏からのご挨拶
我々も、いよいよ「テロメライシン」が最後の段階に来ており、この承認申請はもう絶対に逃したくないと社員一同が思っています。何とかみなさまの期待に応えられるように最善の努力をしていきたいと思っています。
なおかつTransposon社によるビジネス活動に我々も大きく期待しています。我々も手伝えるところはお手伝いしたいと考えています。例えば、日本の大きな製薬会社が「OBP-601」に興味を持ち、もしもライセンスの気持ちがあるなら、お手伝いしたいです。それによって、早く大きなお金が我々に入ってくるように、最大限努力していきたいと思っています。
本日は長時間にわたりご参加いただきまして、本当に厚く御礼を申し上げます。ありがとうございました。
この銘柄の最新ニュース
オンコリスのニュース一覧- 明日の決算発表予定 トヨタ、東エレク、伊藤忠など288社 (2月5日) 2026/02/05
- 腫瘍溶解ウイルスOBP-301製剤の18か月安定性試験結果のお知らせ 2026/02/05
- 前日に動いた銘柄 part2 マツモト、ヒーハイスト、ククレブなど 2026/02/04
- 新興市場銘柄ダイジェスト:エクサウィザーズが続伸、シーユーシーが急騰 2026/02/03
- 注目銘柄ダイジェスト(前場):TDK、京セラ、村田製など 2026/02/03
マーケットニュース
おすすめ条件でスクリーニング
オンコリスバイオファーマの取引履歴を振り返りませんか?
オンコリスバイオファーマの株を取引したことがありますか?みんかぶアセットプランナーに取引口座を連携すると売買履歴をチャート上にプロットし、自分の取引を視覚的に確認することができます。
アセットプランナーの取引履歴機能とは
※アセプラを初めてご利用の場合は会員登録からお手続き下さい。










