【QAあり】クリングルファーマ、脊髄損傷急性期承認申請に向け着実前進 HGFの新たな適応拡大に向けアカデミアとの連携強化
アジェンダ

安達喜一氏:みなさま、こんにちは。クリングルファーマ株式会社代表取締役社長の安達喜一です。2024年9月期第3四半期の決算および業績予想の修正等について、ご説明します。
本日のアジェンダです。初めに2024年9月期第3四半期のトピックスを、当社の成長戦略と併せてご説明します。次に、各開発パイプラインの進捗状況として、脊髄損傷急性期、声帯瘢痕、筋萎縮性側索硬化症(ALS)についてお話した後、2024年9月期第3四半期の決算概況として、業績予想の修正、経営成績・財政状態の概況、減資についてお話しします。
最後に、株主のみなさまの関心が最も高い、脊髄損傷急性期に関するQ&Aをまとめています。
会社概要

当社は2001年に、大学発の創薬バイオベンチャーとして設立されました。企業理念は、「難治性疾患治療薬の研究開発を行い、難病に苦しむ患者さんに対して画期的な治療手段を提供し、社会に貢献すること」です。
当社は現在、再生創薬シーズHGFの医薬品開発に注力しています。このHGFは、日本で発見された、からだの中に存在するタンパク質です。692個のアミノ酸が数珠状につながり、19個の分子内架橋により、スライド左側の絵のような非常に複雑な構造を取っています。
HGFはもともと、肝臓の再生に関わるタンパク質として見つかりました。しかしその後の研究から、肝臓だけでなく、さまざまな組織・臓器の「保護」「再生」「修復」も担う、非常に重要なタンパク質であることがわかりました。
また、細胞を増殖させるだけでなく、抗線維化や細胞死の抑制、血管新生、形態形成、中枢系に対しては、軸索の伸展やグリア細胞の機能維持といった働きもあります。1つのタンパク質で、マルチな生物学的機能を持つのが大きな特徴です。
このHGFの国際一般名称は、「Oremepermin Alfa(オレメペルミン アルファ)」です。当社の強みは、HGFという非常に複雑な構造を持つタンパク質を医薬品のグレードで製造することに成功しており、製造したHGFを使って国内外で複数の臨床試験を行っていることです。
世界中を見渡しても、このような会社はクリングルファーマしかありません。したがって、当社はHGFの開発に関して、ナンバーワン・オンリーワンの企業であると自負しています。
2024年9月期第3四半期のトピックス

2024年9月期第3四半期のトピックスを、3つのカテゴリにまとめています。まず1つ目のカテゴリです。当社の特徴として、国内レイトステージの開発パイプラインを複数有していることがあります。
各パイプラインの進捗については、後ほど詳しくご説明します。
第1パイプラインの脊髄損傷急性期は、第Ⅲ相試験が終了し、現在は承認申請に向けて当局(PMDA)と協議中です。事前面談での論点整理が概ね終了し、申請前相談に向けて準備を進めているところです。一歩一歩着実に前進しているとご理解ください。
第2パイプラインの声帯瘢痕は、第Ⅲ相試験患者の組入れを粛々と進めています。前回の決算説明会でもご説明したとおり、国内の1施設を追加し、現在6施設で症例の組入れを進めています。
第3パイプラインのALSも、前回の決算説明会でご説明したとおり、新たに東北大学との共同研究をスタートしています。現在、第Ⅱ相臨床試験のバイオマーカーに関する追加解析を進めているところです。
2つ目のカテゴリは、アカデミアとの共同研究の推進を挙げています。HGFのオープンイノベーションを推進することにより、HGFの新たな適応を発見し新規のパイプラインを創製するというものです。
前回の決算説明会でご報告したように、岐阜大学との共同研究として、特発性大腿骨頭壊死症への応用研究を開始しています。
また2024年6月には、金沢大学との共同研究を新たにスタートしています。こちらは、特発性肺線維症が対象です。この後のスライドで、詳細をご説明します。
3つ目のカテゴリは、海外でのパートナリング活動です。海外の提携先を獲得する目的で、この第3四半期は積極的に活動しました。こちらも後ほどスライドでご説明します。
適応拡大の新たな可能性:特発性肺線維症(IPF)
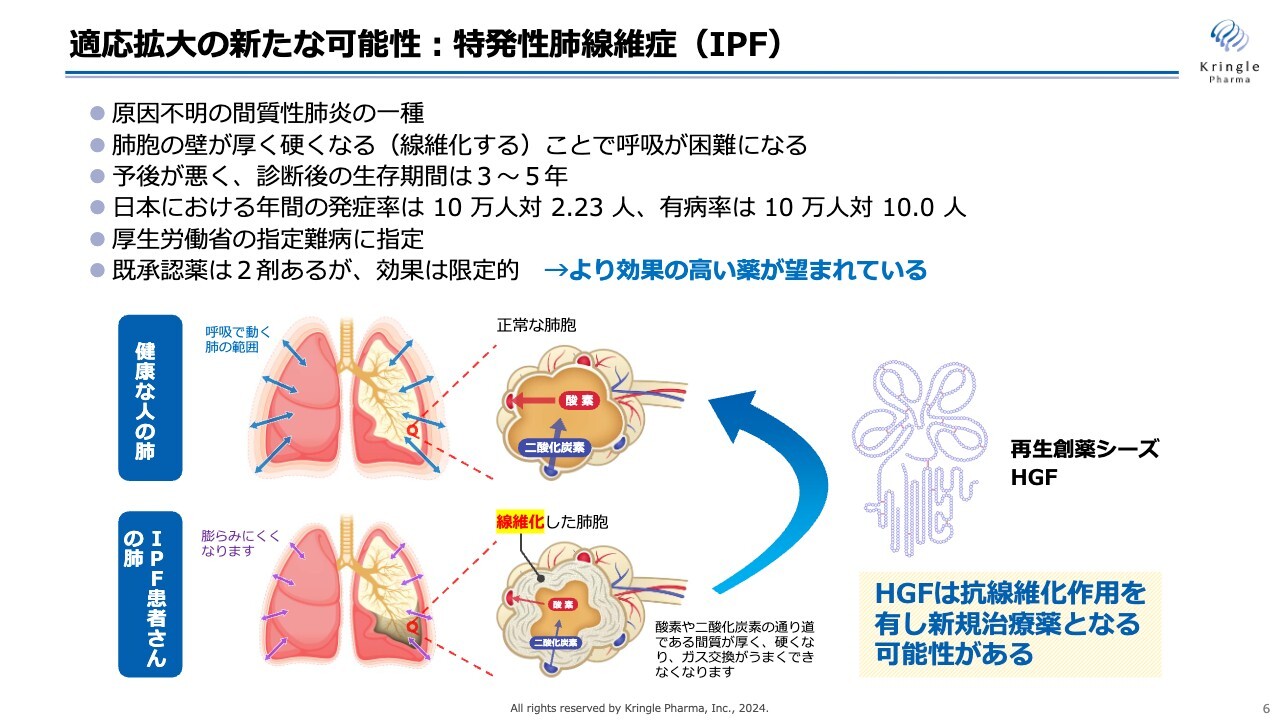
新たな適応拡大の可能性として、金沢大学との共同研究をスタートした特発性肺線維症(IPF)についてお話しします。
この特発性肺線維症は、原因不明の間質性肺炎の一種です。スライドの絵をご覧ください。健康な人の肺は、肺胞が収縮し、酸素と二酸化炭素の交換を行います。それが正常なかたちですが、特発性肺線維症(IPF)の患者の肺は、肺胞が線維化し、きちんと収縮しなくなります。これにより酸素や二酸化炭素の交換がうまくいかなくなり、呼吸が困難になる疾患です。
IPFは予後が大変悪く、診断後の生存期間が3年から5年といわれ、厚生労働省の指定難病に指定されています。既承認薬は2剤ありますが、効果が限定的なため、より効果の高い薬が望まれるアンメットニーズの高い疾患です。
HGFには線維化を解除する抗線維化の働きがあります。これを使って特発性肺線維症の新たな治療薬を開発できないかと、今回、金沢大学と共同研究をスタートしました。まずは金沢大学が持っている動物モデルでHGFの効果を検証することが、共同研究の趣旨です。
適応拡大:声帯瘢痕から他の線維化疾患への展開
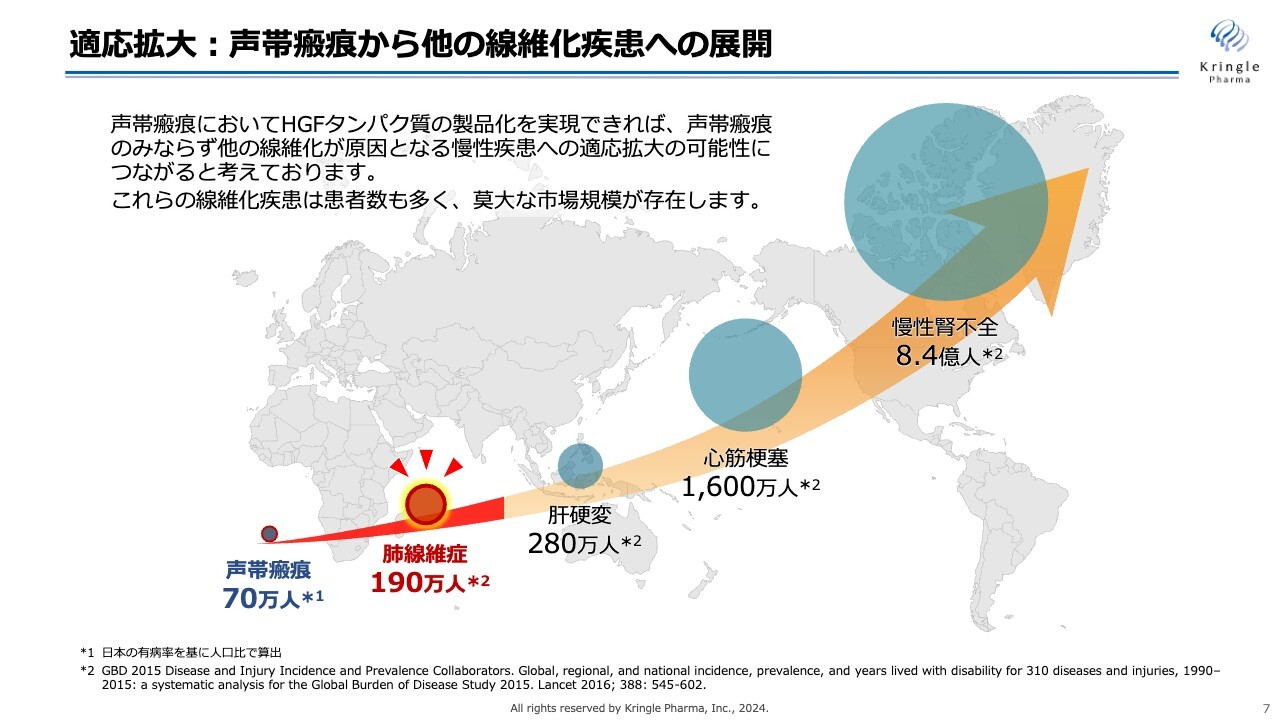
当社は声帯瘢痕を対象に、国内で第Ⅲ相試験を実施しています。こちらも線維化疾患の一種です。当社の戦略は、この声帯瘢痕を入口とし、市場が大きいその他の線維化疾患にまで適応を拡大していくことです。
今回の金沢大学との共同研究は、スライドに赤い線で示している、声帯瘢痕から次の線維化疾患への適応拡大の最初の一歩です。将来的には、患者数の多い肺線維症に適応を拡大させていきたいと考えています。
さらには肝硬変、心筋梗塞、慢性腎不全といった巨大な市場にもチャレンジできればと思っています。
適応拡大の新たな可能性:大腿骨頭壊死症
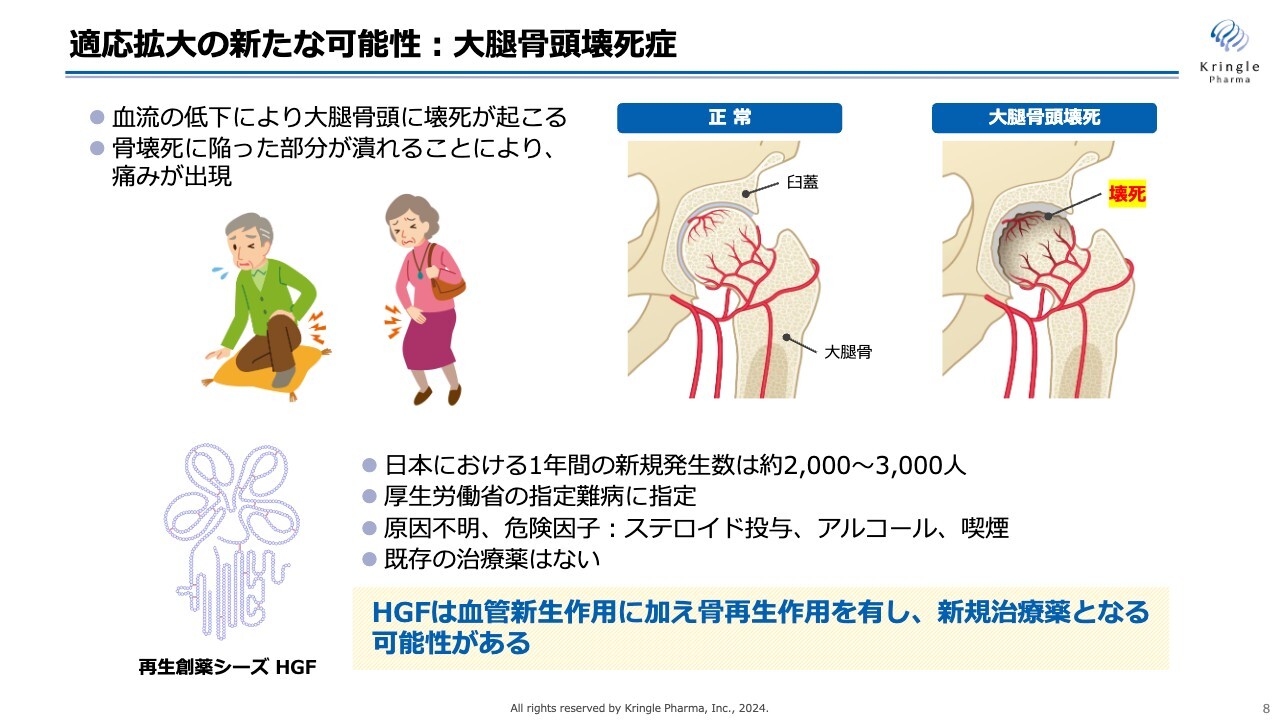
前回の決算説明会でもご説明した、岐阜大学との共同研究についてです。こちらは大腿骨頭壊死症が対象です。この大腿骨頭壊死症も、既存薬のない難病として、厚生労働省の指定難病に指定されています。
HGFの持つ血管新生作用と骨再生作用を使って、大腿骨頭壊死症の新たな治療薬の開発につなげたいと考えており、岐阜大学で共同研究を進めているところです。
このように、当社は国内のアカデミアの先生方と、HGFのオープンイノベーションを積極的に展開しています。HGFの価値を最大化することが当社の成長戦略にもつながります。
海外でのパートナリング活動

当第3四半期は、海外でのパートナリング活動を積極的に行いました。目的は、脊髄損傷急性期及び声帯瘢痕に関する海外の提携先の獲得です。
2024年6月に米国サンディエゴで行われた「BIO 2024 International Convention」に参加し、製薬企業やバイオテック企業と、個別の面談を行いました。
また、同じく6月にサンディエゴで行われた「2nd Annual Spinal Cord Injury Investor Symposium」というシンポジウムにも参加しました。こちらでは、国内での脊髄損傷急性期の第Ⅰ/第Ⅱ相、第Ⅲ相試験を発表し、製薬企業、投資家、患者の団体から非常に高い関心を示されました。
これらの会議の参加を踏まえ、現在、複数社と秘密保持契約下でさまざまなレベルの交渉を進めています。契約が成立するまでは開示できないため、引き続きお待ちいただければと思います。
クリングルファーマの成長戦略
当社の成長戦略をご説明します。
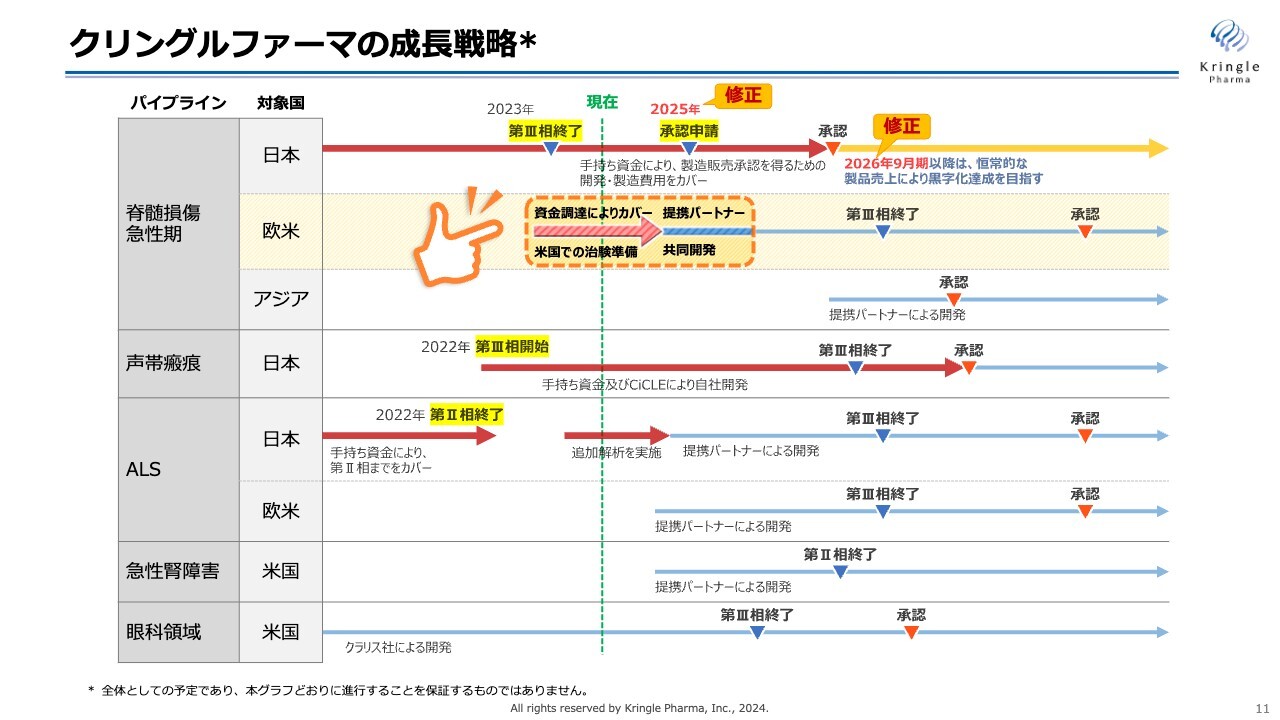
まず、国内での脊髄損傷急性期です。承認申請を行い承認を取ることが、当社の短期的かつ最も大きな目標です。
今回は、2つの修正をスケジュールに加えました。
1つ目は、承認申請です。これまでは今期中の承認申請を目標とし、2024年という数字を挙げていました。現在、PMDAとの事前面談が着々と進んでいるところですが、2024年9月までに承認申請するのが困難なスケジュールとなってきています。現状、来期前半に承認申請ができればと考え、申請のタイミングを2025年に修正しました。
2つ目は、承認申請のタイミングの期ズレに伴い、2025年9月期としてきた上市のタイミングを2026年9月期に修正しています。スライドに示したスケジュールで承認申請し、承認が取れるよう、引き続き全力を注ぎます。
脊髄損傷急性期の欧米での開発は、資金調達により、着実に進捗を進めています。具体的には米国での治験申請(IND)に向けた準備です。こちらは後ほどご説明します。
第2パイプラインの声帯瘢痕については、第Ⅲ相試験患者の組入れを粛々と進めています。こちらは第Ⅲ相試験の終了・承認を得るまで、手持ち資金及びCiCLE補助金により自社開発する予定です。
第3パイプラインのALSは、第Ⅱ相試験の追加解析を実施しています。この結果をもとに、提携パートナーを得る方針です。
スライドの矢印を計画どおりに進めることが、当社の短期的な成長戦略です。
今後の成長戦略と資金調達の位置づけ
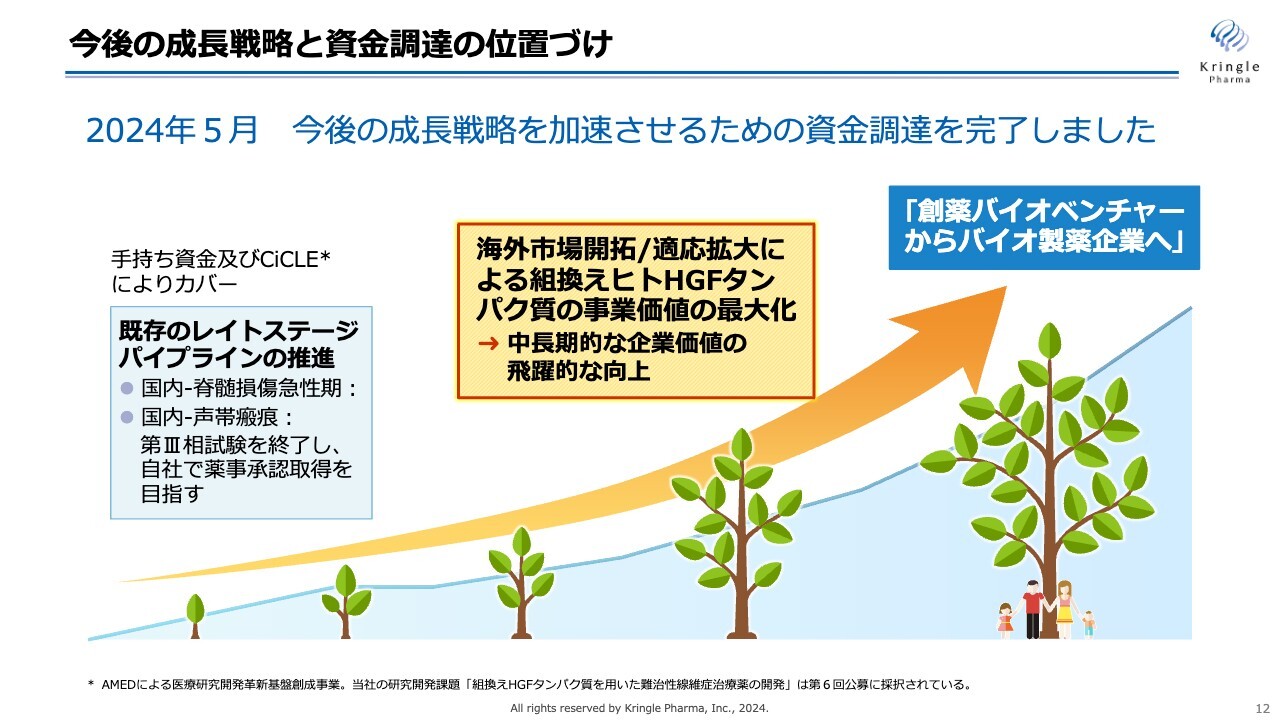
中長期的に、当社は「創薬バイオベンチャーからバイオ製薬企業へ」と自ら成長していくことを考えています。その成長戦略は、大きく2つあります。
1つ目は海外市場をいち早く開拓すること、2つ目はHGFの適応拡大によりHGFの価値を最大化することです。この2本立てで中長期の成長を遂げ、バイオ製薬企業へと成長していきたいと考えています。
2023年9月に、新株予約権を介した資金調達をローンチしており、2024年5月に行使がすべて完了しています。得られた調達金額を使って、海外市場開拓・適応拡大を加速していくことが重要だと考えています。
新株予約権発行による資金調達 完了
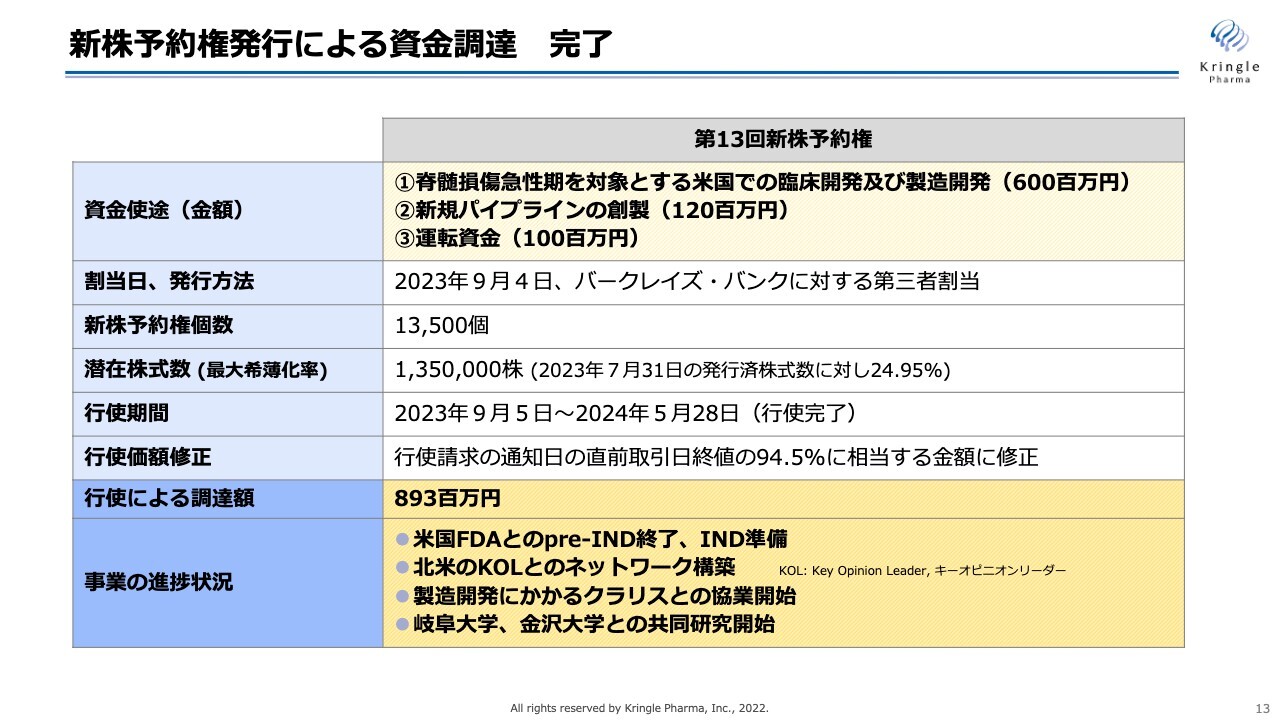
スライドは、新株予約権発行による資金調達をまとめたものです。資金使途は、「脊髄損傷急性期を対象とする米国での臨床開発及び製造開発」「HGFの適応拡大:新規パイプラインの創製」「運転資金」です。
2023年9月から行使がスタートし、2024年5月末に行使がすべて完了しています。最終的には、8億9,300万円の資金を調達することができました。
現在はこちらの資金を使って事業を進めています。具体的には、米国FDAとのpre-INDが終了し、INDの準備に入っています。
すでに北米のKey Opinion Leader(KOL)の先生方とのネットワークを構築し、さまざまな有益なアドバイスをいただきながら、INDの準備を進めています。
また、クラリス・バイオセラピューティクス社(以下、クラリス社)との協業を拡大し、製造開発にかかる協業を進めています。
さらには、岐阜大学、金沢大学との共同研究を開始し、HGFの新たな適応拡大につなげたいと思います。
ここには示していませんが、さらに多くのアカデミアとのさまざまな話が進んでいます。こちらについても、共同研究の契約が締結できましたら開示したいと考えています。
収益イメージ図
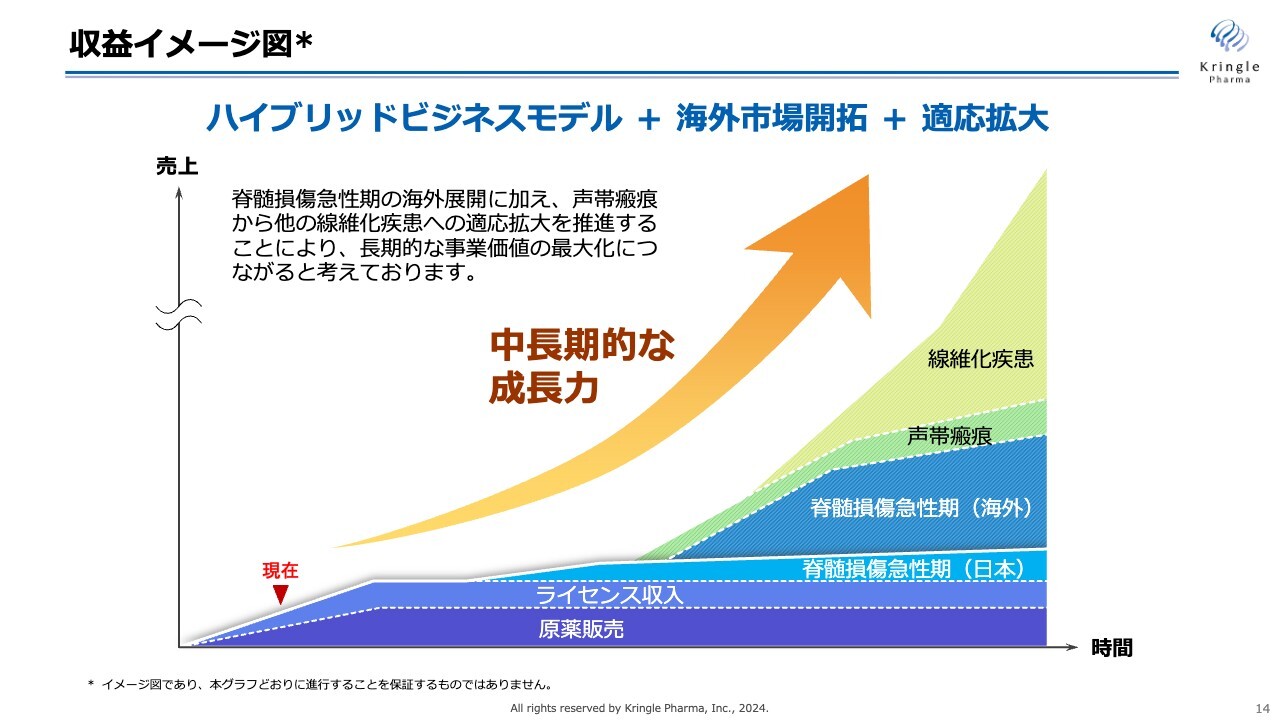
当社の描く未来は、海外市場開拓や適応拡大を進めることで中長期的に飛躍し、最終的には当社自らがバイオ製薬企業へと成長することです。
開発パイプラインの概要
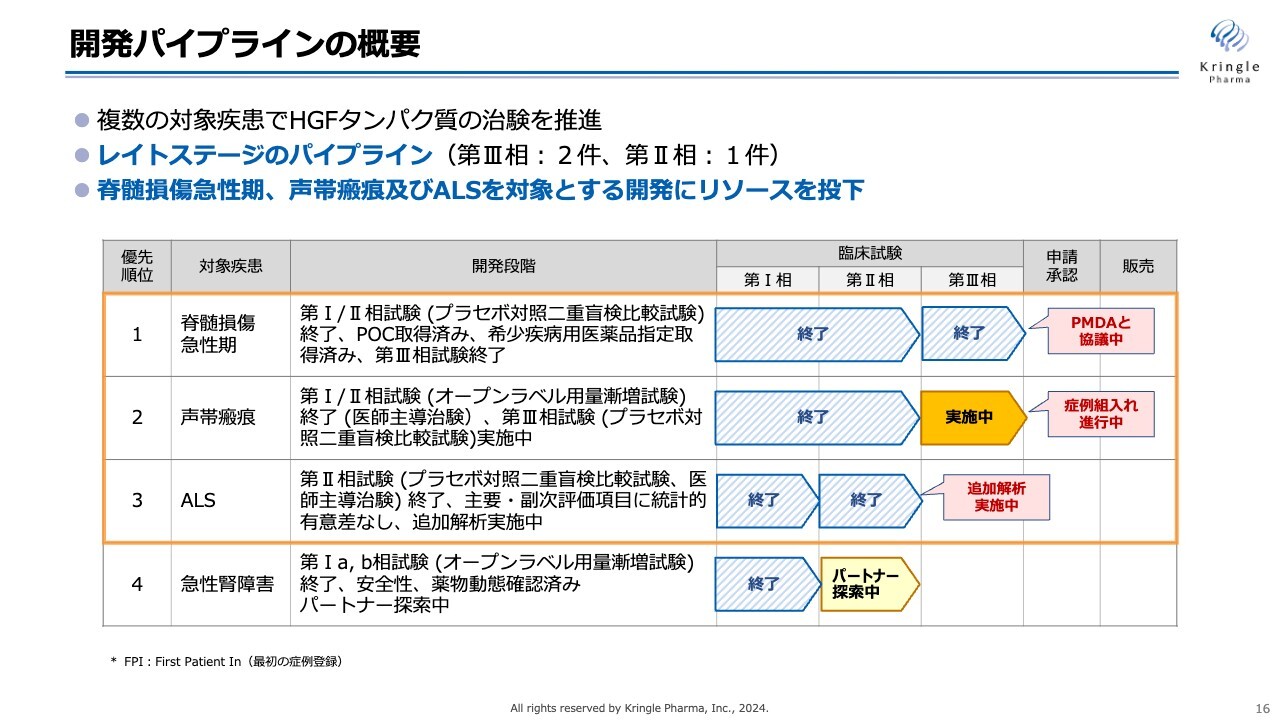
各開発パイプラインの進捗状況についてご説明します。スライドの図は、当社の臨床段階にある開発パイプラインをまとめたものです。
第1パイプラインの脊髄損傷急性期は、第Ⅲ相試験が終了し、現在はPMDAと協議を進めているところです。第2パイプラインの声帯瘢痕は、第Ⅲ相試験を国内で実施中です。第3パイプラインのALSは、第Ⅱ相試験が終了し、バイオマーカーに関する追加解析を実施中です。
当社は、HGFタンパク質の臨床開発を複数の難病に対して同時並行で進めており、レイトステージのパイプラインを複数有しています。
開発パイプライン-脊髄損傷急性期-

開発パイプラインの概要についてご説明します。
まず、第1パイプラインの脊髄損傷急性期です。日本では現在、さまざまな原因により年間約6,000人の方が脊髄損傷になると言われています。高齢化社会を反映し、お年寄りの転倒、転落による脊髄損傷が増えているのが特徴です。
脊髄損傷は損傷部位が脳に近いほど広範な麻痺が残り、急性期については薬剤あるいは手術などによる根本的な治療法がない状況です。患者だけではなくご家族、あるいは介護される方の負担が非常に大きく、アンメットニーズが非常に高い疾患です。
脊髄損傷急性期にHGFに期待する治療効果
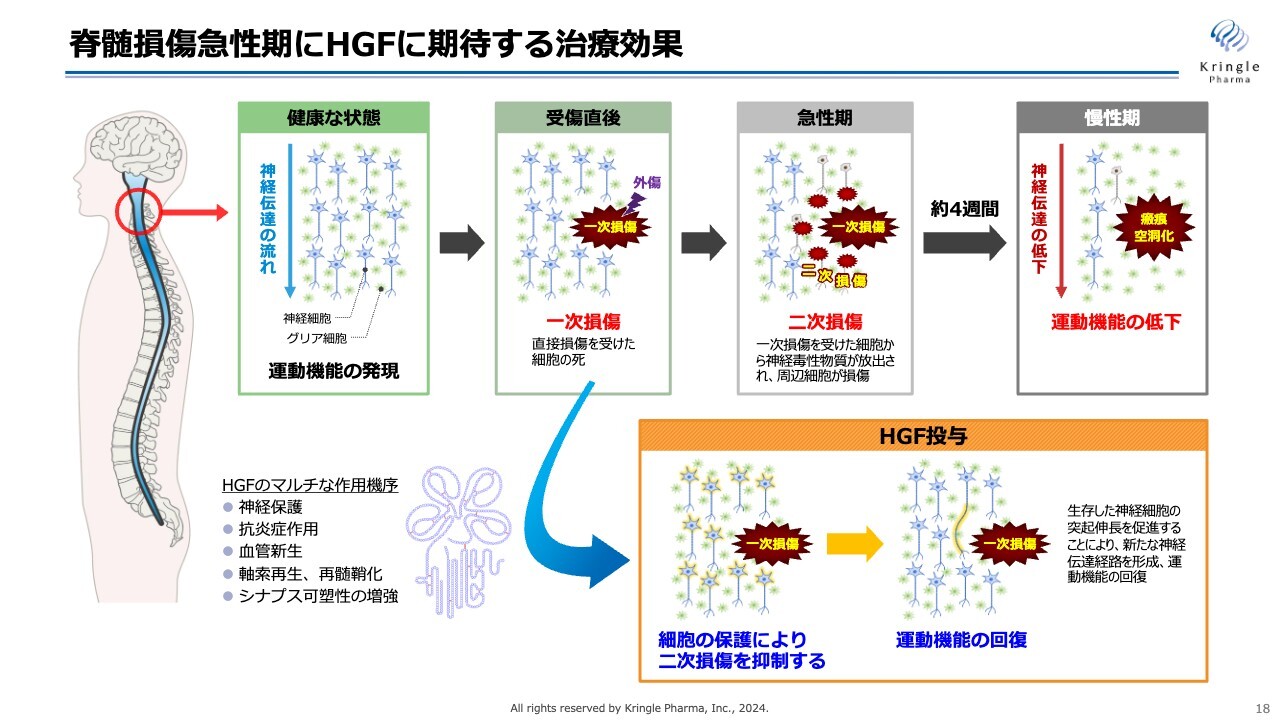
脊髄損傷急性期でHGFに期待する治療効果をスライドにまとめています。上のラインが脊髄損傷受傷後から急性期、慢性期に至るまでに起こるイベントを図示しています。
最初の損傷を一次損傷と言いますが、急性期には、この一次損傷から二次損傷として周りの組織、細胞へ損傷が広がっていきます。慢性期になると、この広がった損傷範囲が最終的に瘢痕化し、さらに空洞化して、神経伝達が上から下に伝わらなくなり、運動機能が低下します。
一方で、HGF投与に期待することをスライドの下部に表しています。ここに挙げている神経保護、抗炎症作用、血管新生、軸索再生、再髄鞘化、シナプス可塑性の増強などHGFのマルチな働きによって、一次損傷から二次損傷が広がっていくことをできるだけ抑えます。損傷範囲を抑制し、慢性期に運動機能の回復を期待するものです。
脊髄損傷急性期 第I/II相試験の結果
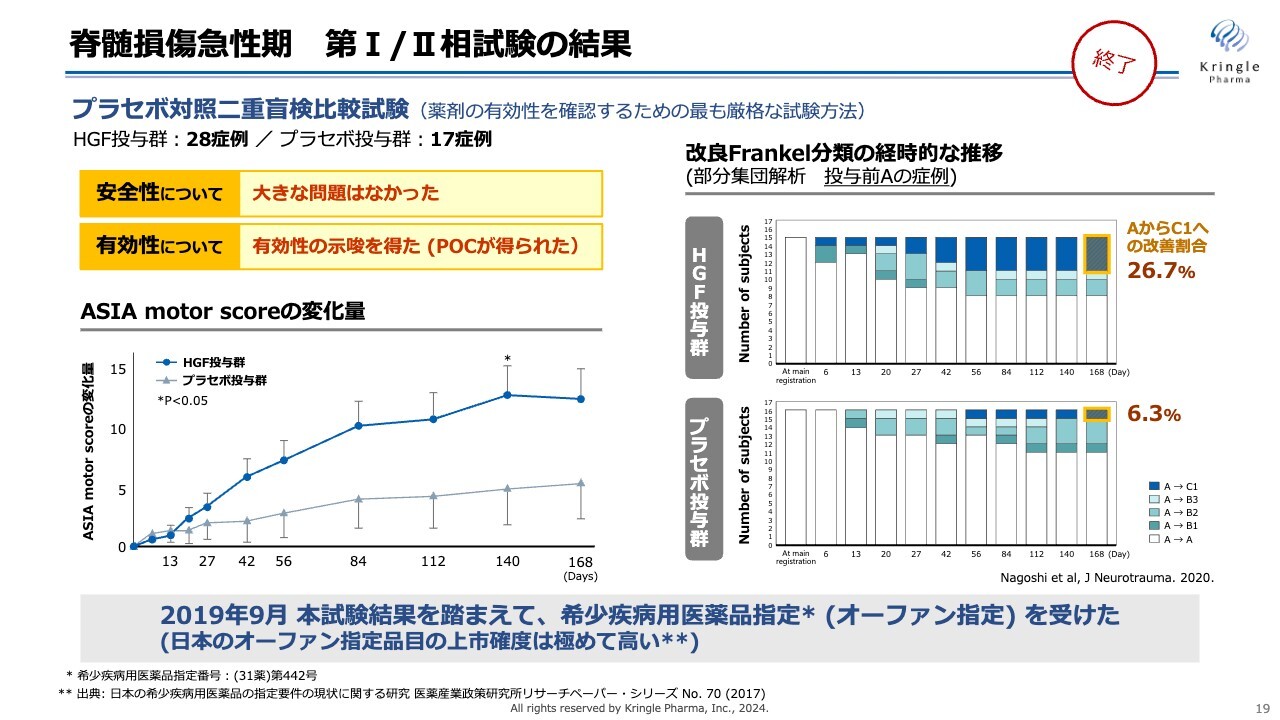
すでに終了した第Ⅰ、第Ⅱ相試験の結果を表したものです。この試験はプラセボ対照二重盲検比較試験で、HGF群28症例、プラセボ投与群17症例を比較したものです。安全性について大きな問題はなく、有効性については非常にポジティブな結果を得ることができました。
スライド左下のグラフは「ASIA motor score」をHGF群とプラセボ投与群で比較したものです。HGF群は濃い青い線で示しています。6ヶ月の経過観察期間全体にわたり、プラセボ群よりも高いスコアを獲得しています。
Day140では、統計的な有意差も得られています。
スライド右側のグラフは、重症度の推移を色をつけて表しています。「投与前重症度A」は完全麻痺で、最も重症度の激しい脊髄損傷の状態ですが、6ヶ月の間にAからB、あるいはAからCへと改善した症例数を表しています。青色はAからCの2段階の改善をした方になります。
プラセボ投与群でも自然回復として6.3パーセントの方がAからCに回復していますが、HGFを投与した群では26.7パーセントと、プラセボ投与群の4倍以上の方がAからCへの改善を見ています。
これらの結果を踏まえ2019年9月に希少疾病用医薬品指定、いわゆるオーファン指定を国内で得ることができ、その後、第Ⅲ相試験に進みました。
脊髄損傷急性期 第III相試験(医薬品開発の最終段階)
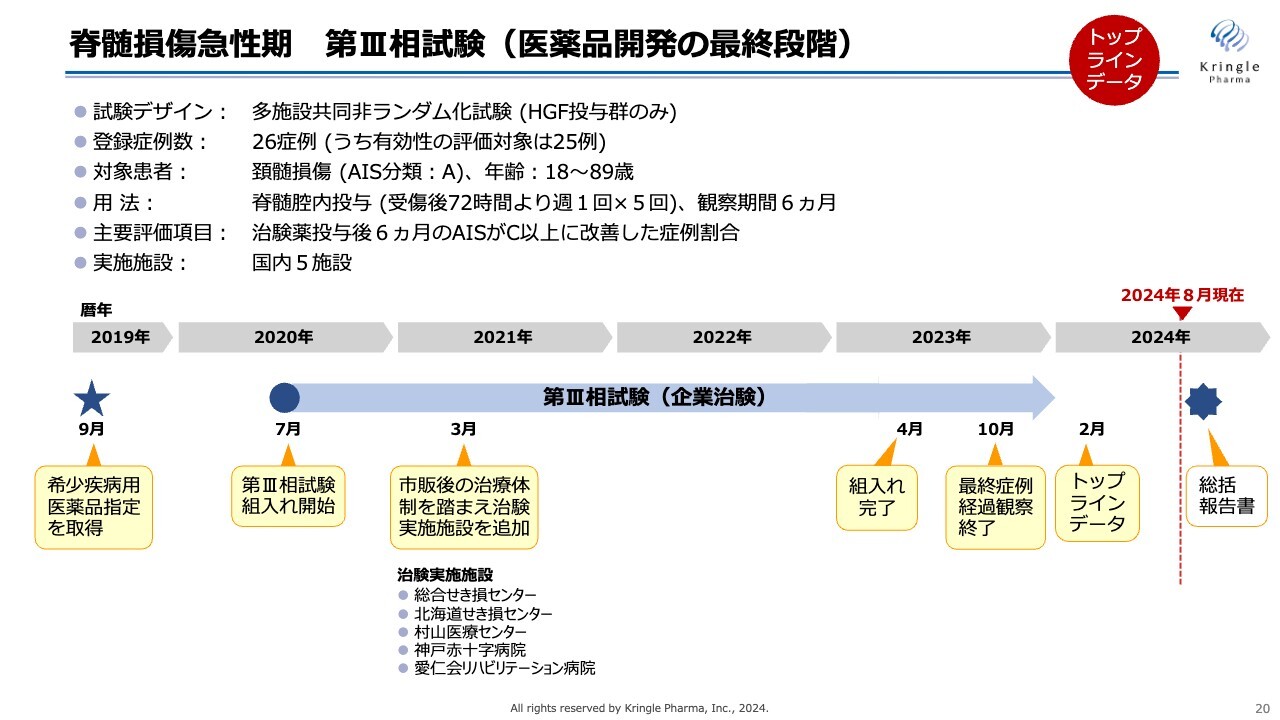
第Ⅲ相試験の概要です。特徴としては、非ランダム化試験ということで、すべての患者にHGFを投与しています。この試験は2020年から組入れをスタートしました。新型コロナウイルスのパンデミックまっただ中での試験となり、大変苦労しました。
最終的には2023年4月に組入れを終了し、2024年2月にトップラインデータを公開しました。現在、総括報告書の取りまとめの最終段階に入っており、まもなく総括報告書ができます。
対象患者は、頚髄損傷の重症度Aという最も重度な完全麻痺の患者のみです。用量・用法は前相と同様で、主要評価項目は治験薬投与後6ヶ月の重症度がC以上、つまり2段階以上改善した症例割合としています。
脊髄損傷急性期 第III相試験 -重症度の改善-
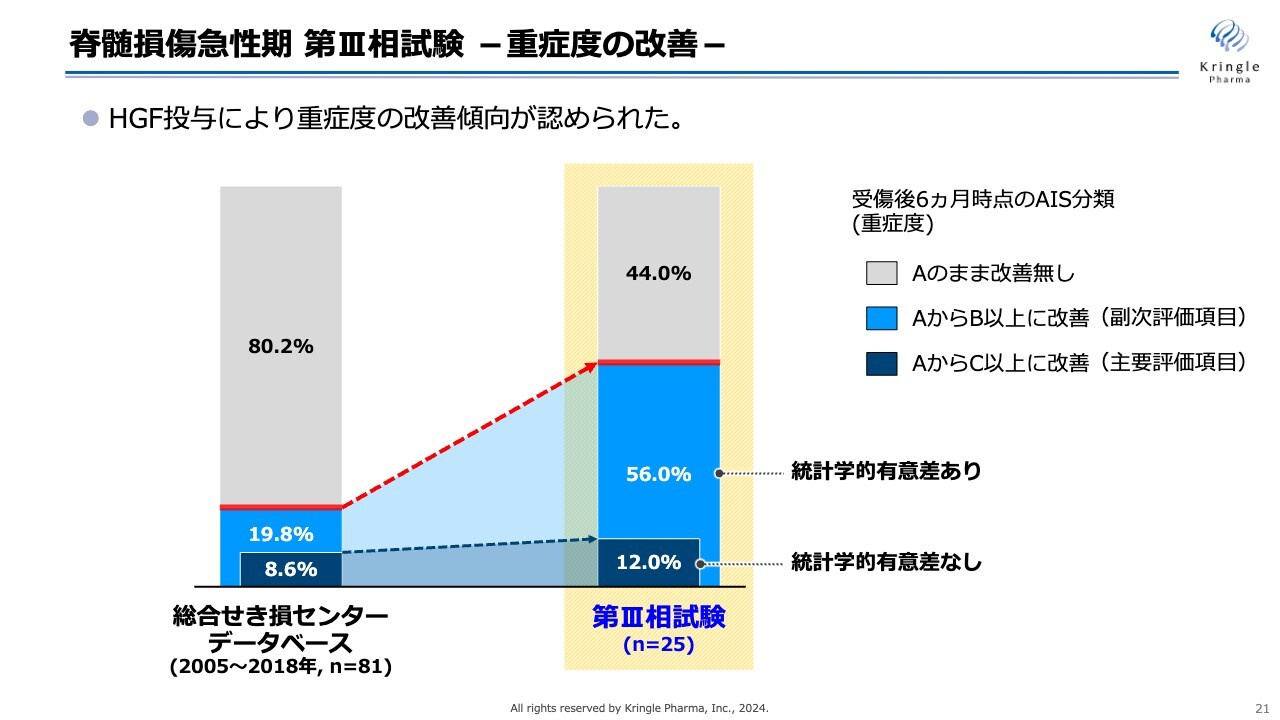
トップラインデータからの抜粋になりますが、スライドのグラフの中央部、黄色で囲ってあるところが今回の第Ⅲ相試験、25症例の重症度の改善を棒グラフにしたものです。
比較対象は、総合せき損センターが保有しているデータベースの数値です。こちらのデータベースは1,000名以上の患者のデータが保管されていますが、その中から頚髄損傷受傷後3日目で重症度A、かつ6ヶ月時点でのデータがきちんと揃っている患者を抽出したものです。
グレーの部分は重症度Aのままで改善がなかった方です。ご覧のとおり、薄い青色で示した「AからB以上に改善」、つまり1段階以上改善した方は、データベースで19.8パーセントのところ、今回の第Ⅲ相試験では56パーセントです。半分以上の方がB以上に改善し、非常に大きな改善を見ています。また、この数値には統計学的な有意差が認められています。
一方、主要評価項目として設定した「AからC以上に改善」、2段階以上の改善を濃い青色で示しています。数値としてはデータベースに比べて大きくなっていますが、こちらには統計学的な有意差がなかったというのが今回の第Ⅲ相試験の結果になります。
脊髄損傷急性期 第III相試験 -重症度の改善、海外データベースとの比較-
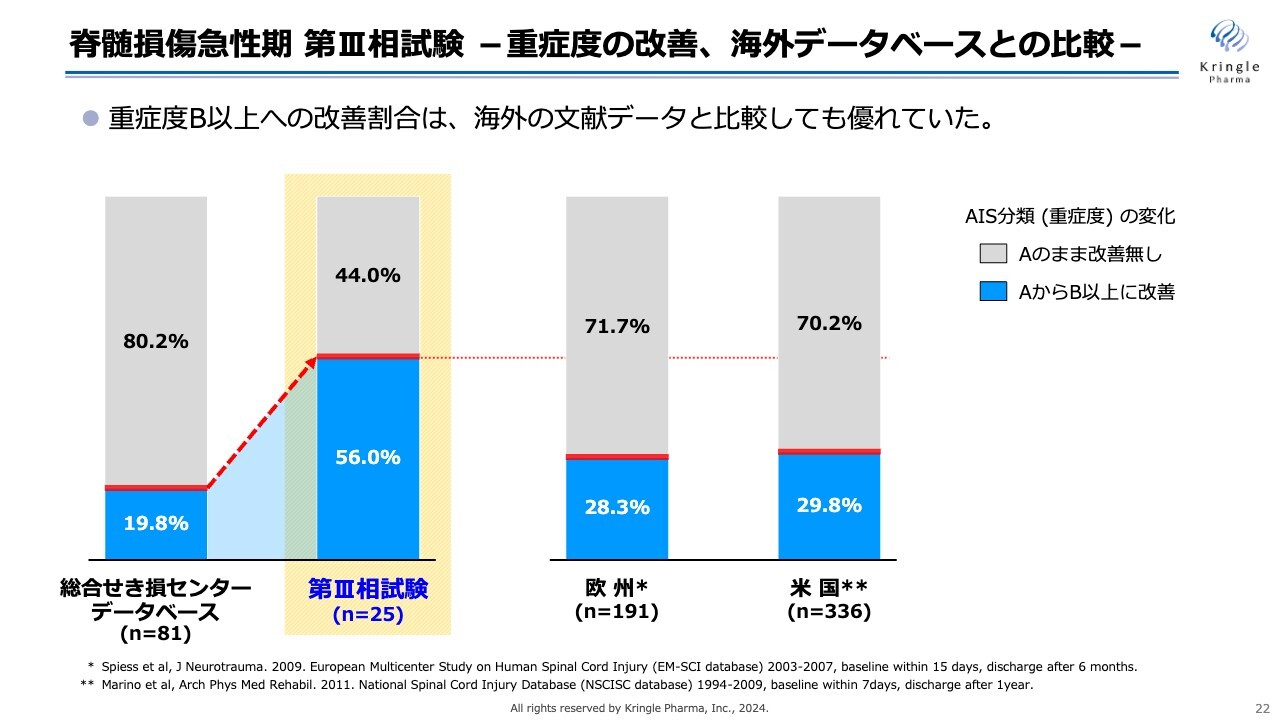
今回の試験の結果は海外のデータベースと比べても非常に優れていることがわかっています。アメリカあるいは欧州のデータベースの数値が文献で発表されていますが、頚髄損傷で重症度A、完全麻痺の方というのは、基本的には7割の方が重症度Aのまま推移しています。
そのため、第Ⅲ相試験でHGFを投与することで半分以上の方がAからB以上に改善したという事実は、国内のデータベースだけではなく海外のデータベースと比較しても非常に優れた結果であるといえます。
急性期完全麻痺患者に対するHGFの効果
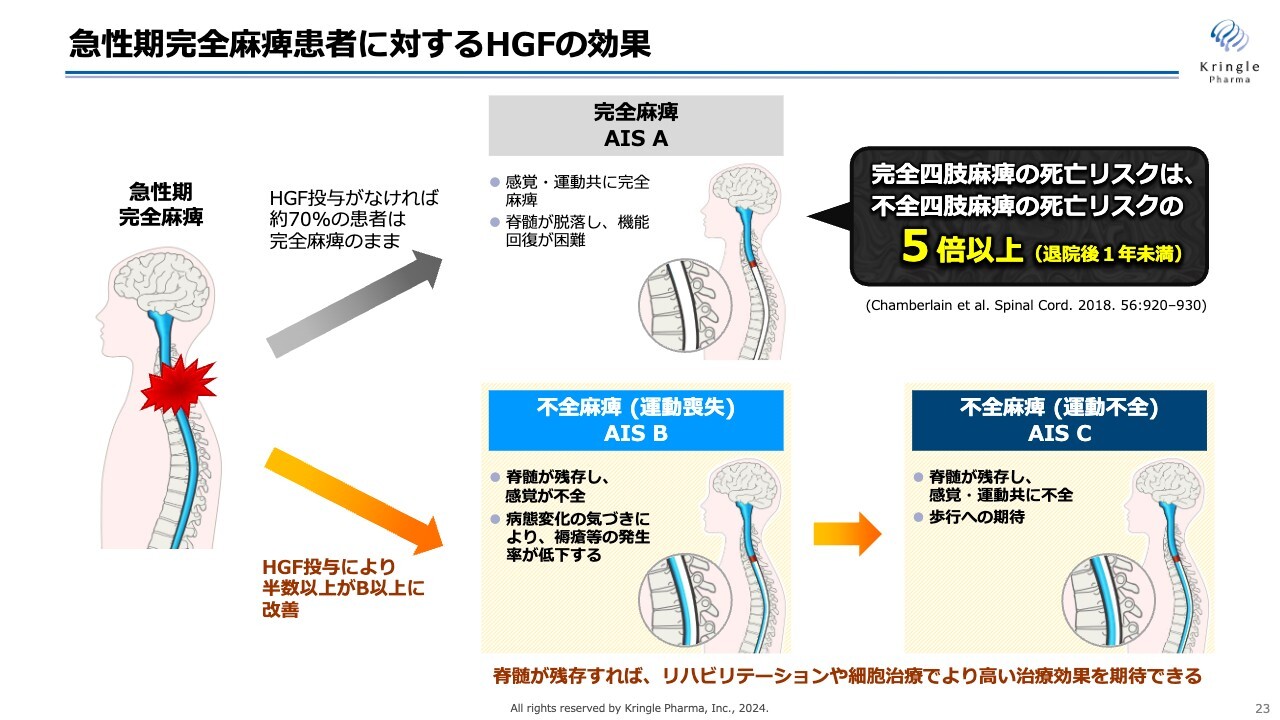
重症度AからB以上に改善することは、どのような意義があるのかについてまとめました。
頚髄損傷で重症度A、完全麻痺の方は、何もしなければ約7割の方がそのまま完全麻痺で慢性期に移行してしまいます。しかしながら、慢性期で完全麻痺、重症度Aの方は脊髄が脱落してしまうため、これ以上の感覚、運動機能の回復が期待できないという非常にシビアな状況にあります。
一方で、今回、急性期にHGFを投与することで半分以上の方がスライドの下のライン、いわゆる不全麻痺のラインに来ることがわかりました。不全麻痺というのは、重症度Bであれば感覚が、重症度Cであれば運動機能が戻ってきます。
この不全麻痺のラインに来ると、その後リハビリテーションを継続する、あるいは現在開発されている細胞治療を施すことによって、さらに機能回復が期待できます。
脊髄損傷の急性期治療で最も重要なことは、重症度が完全麻痺のAのままで患者を上のラインに進めるのではなく、できるだけ多くの方を下のラインに持ってくることです。そして、脊髄が残存すれば、リハビリテーションあるいは細胞治療でより高い治療効果が期待できます。
文献では、完全四肢麻痺の方の死亡リスクは不全四肢麻痺の方の死亡リスクの5倍以上という報告もあります。
繰り返しになりますが、脊髄損傷急性期の治療で最も重要なことは、完全麻痺の方をできるだけ多く不全麻痺のラインに持ってくることです。今回HGFの投与により半数以上の方が下のラインに来ることが第Ⅲ相試験の結果でわかったという事実は、非常に大きいです。
脊髄損傷急性期 承認申請に向けた準備状況
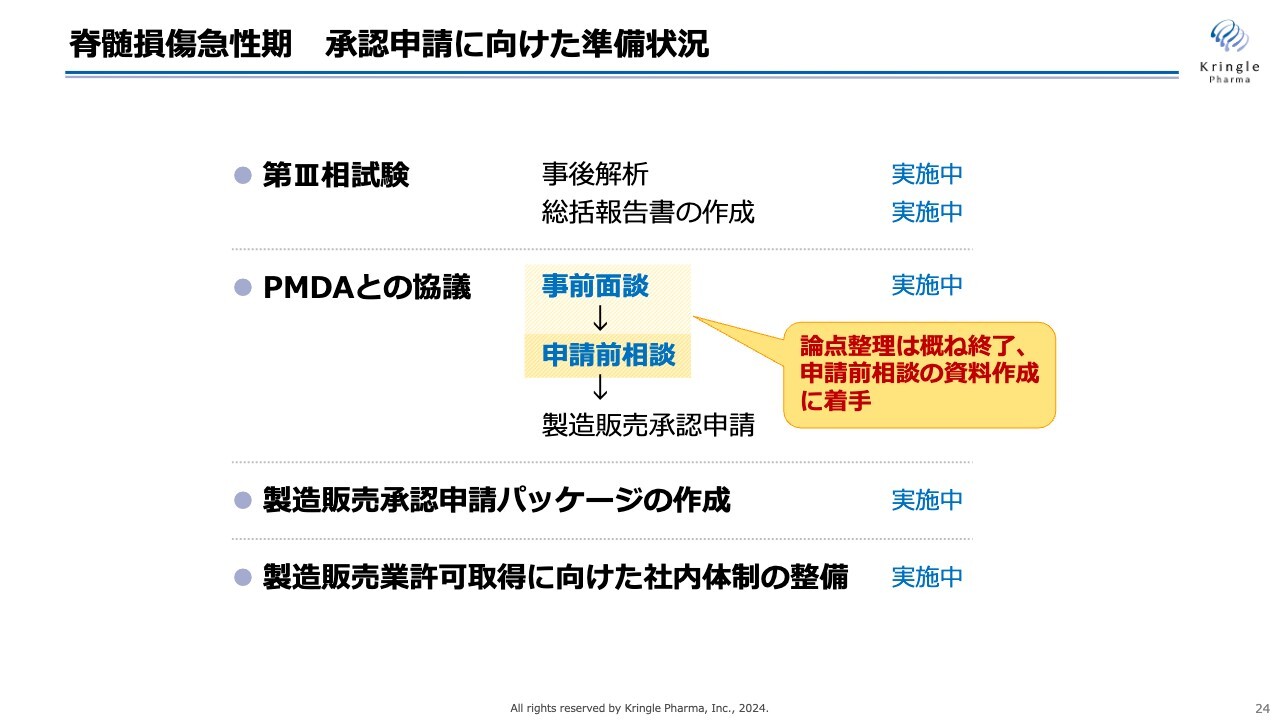
承認申請に向けた準備の状況についてです。第Ⅲ相試験は、事後解析も進め、総括報告書の取りまとめの最終段階に入っています。一方、PMDAとの協議は事前面談の段階にあり、論点整理がおおむね終了しました。
現在、次の段階である申請前相談の資料作成に着手しています。申請前相談でPMDAに細かい点を見ていただき、問題なければ承認申請に進みます。承認申請に向け着実に進めています。
先ほどスケジュールの修正を示したように、もともと承認申請は今年の9月までを想定していましたが、事前面談で論点整理に時間がかかり、今期中の承認申請は難しい状況です。
スケジュールを修正し、承認申請のタイミングとしては来期前半の2025年の初頭を考えています。
承認申請するためのパッケージの作成、あるいは承認申請するための製造販売業許可の取得に向けた社内体制の整備はほぼ完了しています。
開発パイプライン-声帯瘢痕-

第2パイプラインの声帯瘢痕についてご説明します。
声帯瘢痕というのは線維化疾患の一種の難病です。声帯が何らかの原因で線維化してきちんとバイブレーションしなくなることで声が出にくく、ひどくなると声が出なくなってしまうという希少疾患です。現在、有効な治療薬、治療法がないアンメットニーズの高い疾患です。
声帯瘢痕に対するHGFの作用機序
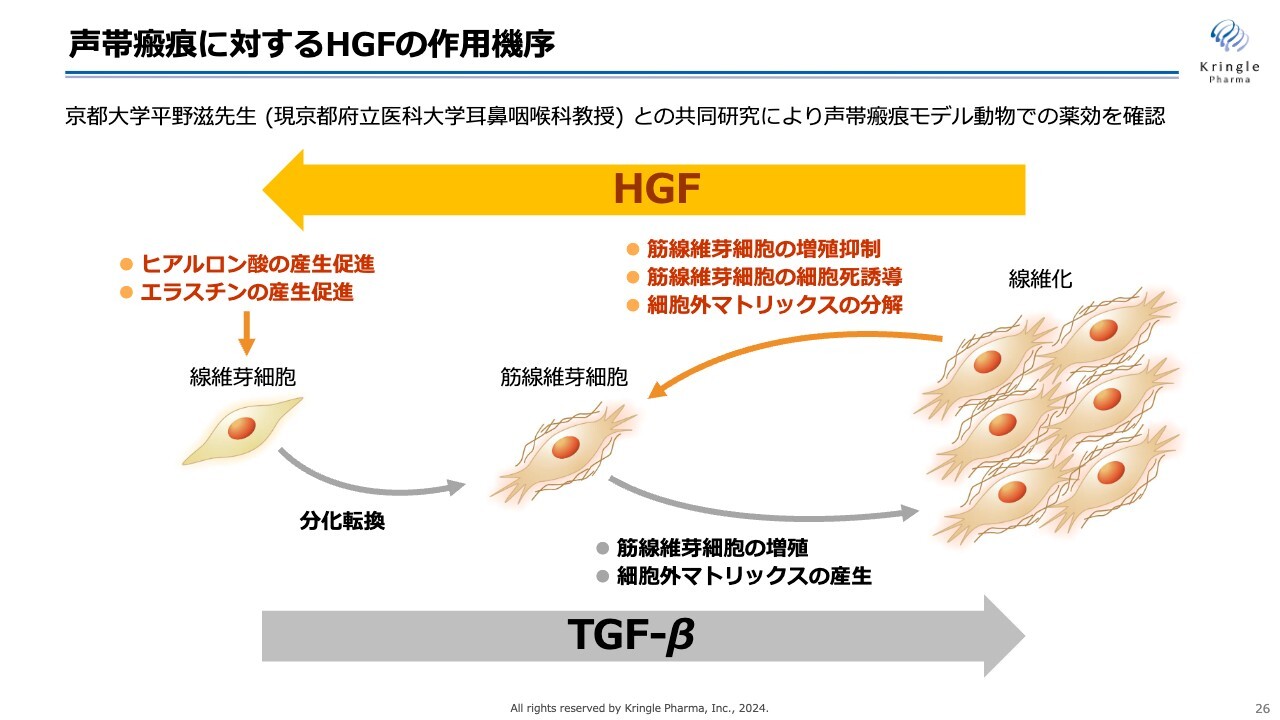
HGFの持つ抗線維化作用によって、線維化した声帯を元に戻すことを期待しています。
TGF-βという生体内タンパク質が線維化を押し進めるタンパク質として知られていますが、HGFにはこれを逆向きに進めるマルチな働きがあるため、これを線維化疾患、声帯瘢痕の治療薬として実用化できないかと考えています。
声帯瘢痕 第I/II相試験の結果
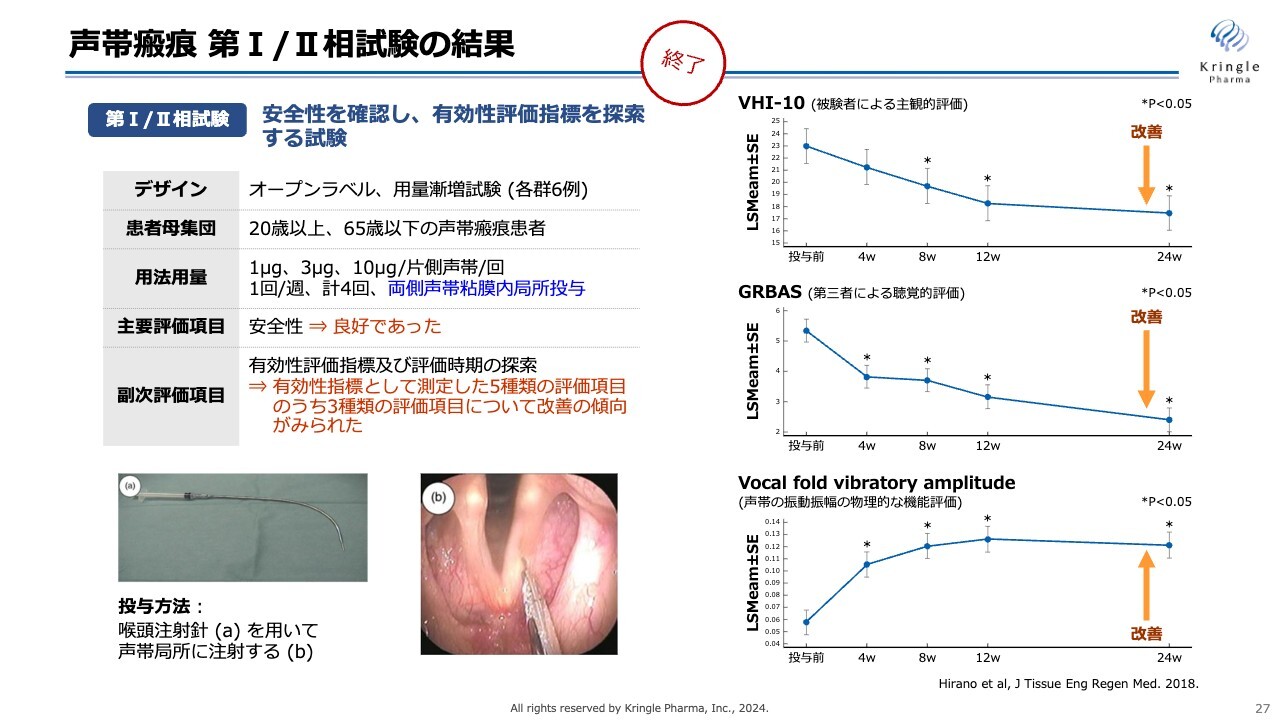
当社はすでに第Ⅰ/第Ⅱ相試験を終了しています。声帯瘢痕の患者トータル18名を対象に、用量を3段階に振り、声帯の局所にHGFを投与し、さまざまな指標で有効性を検証しました。結果、スライドの右側にある3つの評価項目で改善傾向を認めることができました。
また、統計的な有意差も得られています。
声帯瘢痕 第III相試験(医薬品開発の最終段階)
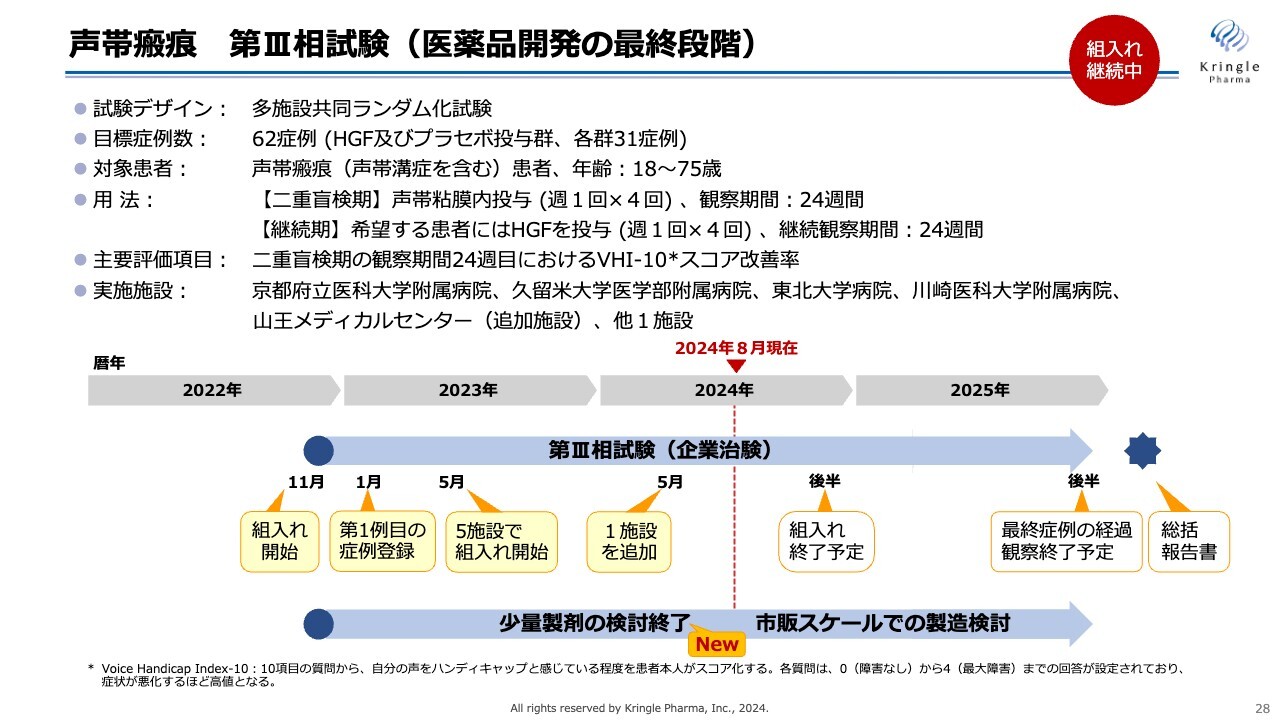
現在、第Ⅲ相試験に入っており、医薬品開発の最終段階でプラセボ対照二重盲検比較試験としてデザインしています。
トータル62症例(HGF群及びプラセボ投与群、それぞれ31症例)を目標症例数とし、声帯の局所に週1回の投与を4回行って6ヶ月観察する二重盲検期と、その後、希望する方全員にHGFを投与する継続期6ヶ月を組み合わせた治験となっており、1人の患者が最長で1年間この治験に参加することになっています。
この試験は現在、患者の組入れを国内の6施設で進めており、今年の年末までに組入れを終了し、来年の年末までに最終症例の経過観察が終了することを期待しています。当第3四半期のアップデートとしては、スライド最下部にある少量製剤の検討を終了することができました。
声帯瘢痕に対しては、非常に少量のHGFを局所に注射するため、声帯瘢痕用の少量製剤を検討していました。こちらの検討が無事に終了し、今後は市販スケールでの製造検討として、具体的にはプロセスバリデーション等を行っていく予定です。
開発パイプライン -ALS-

第3パイプラインである、ALSです。現在、国内では約1万人の方がALSに苦しんでいると言われています。運動神経の細胞死に起因し、徐々に体が動かなくなり、最終的には呼吸ができなくなって死に至る、神経難病の象徴的な疾患です。
既存薬は2剤ありますが、効果は限定的です。引き続き、効果の高い薬が望まれているアンメットニーズの高い疾患です。
ALS 第II相試験(医師主導治験)

当社は、すでに東北大学と共同で医師主導治験第Ⅱ相試験を終了しています。こちらはプラセボ対照二重盲検比較試験であり、HGF投与群32例、プラセボ群14例を比較した試験でした。
主要評価項目、あるいは副次評価項目で統計的な有意差はありませんでしたが、HGF投与群では進行が遅い患者さんも認められました。そのため、さらなる詳細な解析が必要であり、今般、東北大学と共同研究を新たにスタートしました。神経変性または神経炎症のバイオマーカーを測定して、HGF投与による効果を検証することを目標にしています。
こちらの共同研究の結果は、今年度中にはまとまると思います。結果が出次第、あらためてご報告します。
2024年9月期業績予想の修正
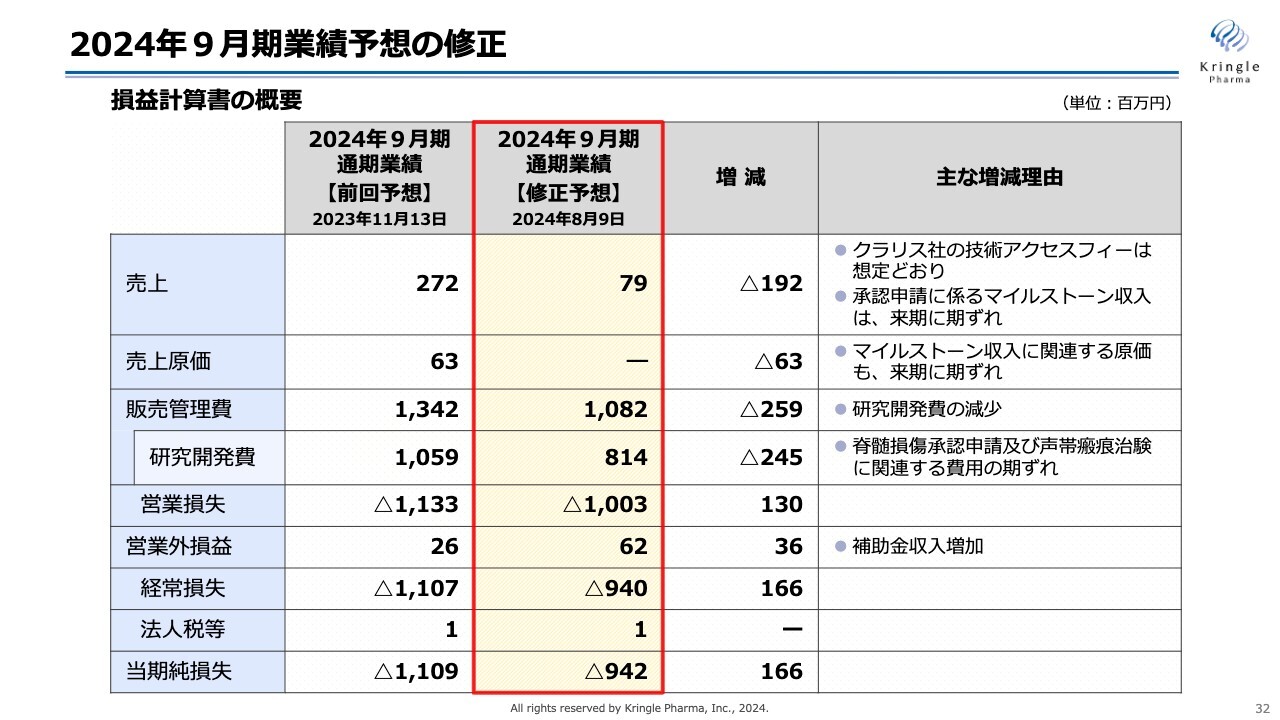
2024年9月期第3四半期の決算概要についてご説明します。こちらが、本日開示した2024年9月期通期業績予想の修正についてまとめたスライドです。
まずは売上です。従前は2億7,200万円を予想していましたが、この度、7,900万円に修正しました。主な理由は、クラリス社の技術アクセスフィーは想定どおり売上として入ってきたものの、脊髄損傷急性期の承認申請のタイミングが来期に期ズレすることになり、それに伴うマイルストーン収入が来期にズレた分を減少しています。
売上原価については、マイルストーン収入に関連する原価も来期に期ズレするため、今回はなしと予想しています。
研究開発費については、従前と比べて2億4,500万円減少し、8億1,400万円と予想しています。この理由としては、脊髄損傷急性期の承認申請のタイミングが来期に期ズレすること、そして声帯瘢痕の治験に関連する費用の一部が来期に期ズレすることから、減少を予想しています。
販売管理費は10億8,200万円、営業損失はマイナス10億300万円、営業外損益は補助金収入が増加したため6,200万円と予想しています。経常損失はマイナス9億4,000万円、当期の純損失はマイナス9億4,200万円を今回の修正予想としています。
2024年9月期第3四半期 経営成績の概況
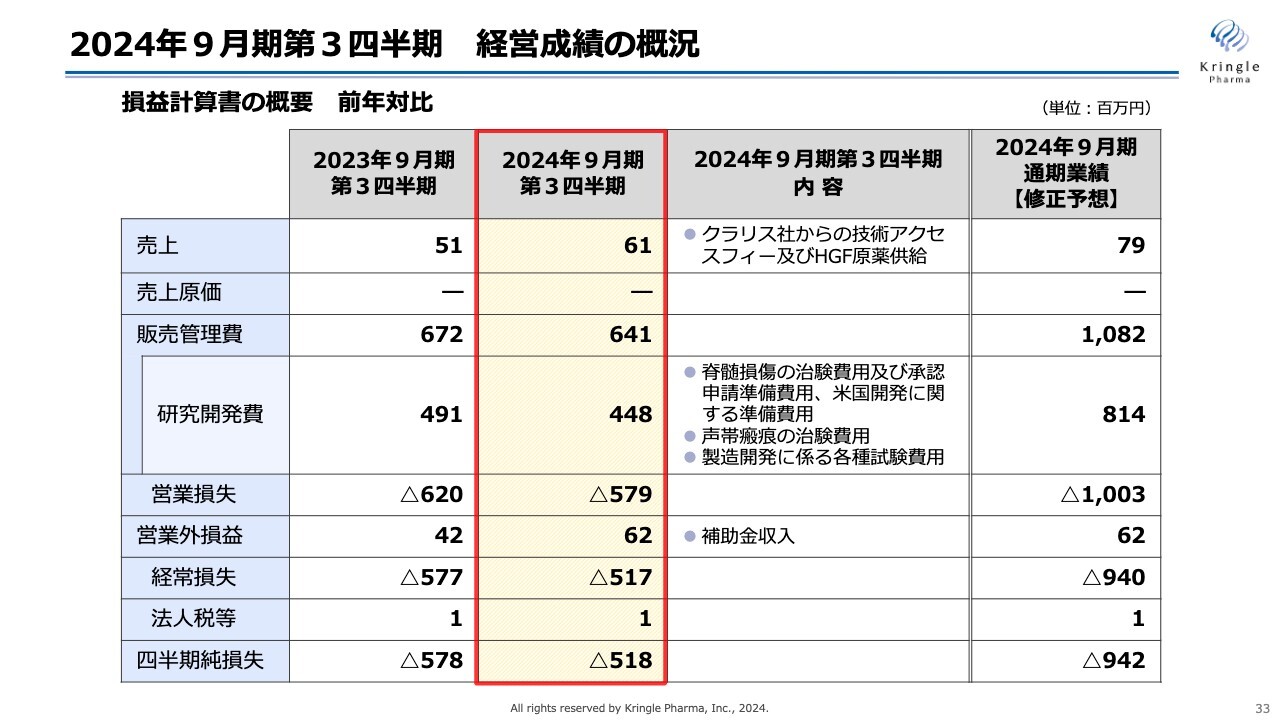
2024年9月期第3四半期の経営成績の概況について、損益計算書の概要を示しています。スライド左側が前年、右側の黄色い部分が当第3四半期です。
数字としては、前年とほぼ同じです。売上は6,100万円で、こちらはクラリス社からの技術アクセスフィーおよびHGFの原薬供給に関するものです。
研究開発費は4億4,800万円で、内訳は脊髄損傷急性期、声帯瘢痕の開発費用および製造開発に係る各種試験費用となっています。
販売管理費は6億4,100万円、営業損失はマイナス5億7,900万円、営業外損益は補助金の収入が増えていることから6,200万円、経常損失はマイナス5億1,700万円、四半期純損失はマイナス5億1,800万円となっています。
2024年9月期第3四半期 財政状態の概況
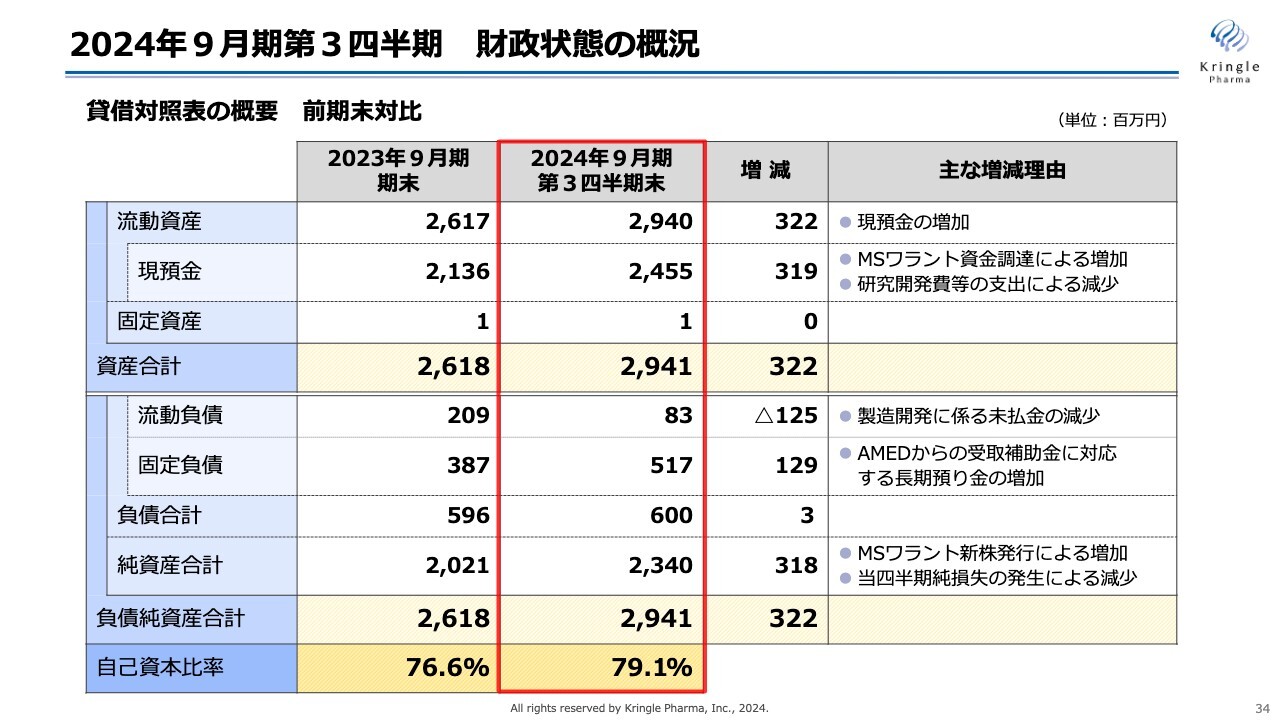
2024年9月期第3四半期の財政状態の概況です。貸借対照表の概要を、前期末と対比して示しています。
流動資産は29億4,000万円です。このうち現預金が24億5,500万円となっており、前期末と比べて3億2,200万円増加しています。こちらは、MSワラントの資金調達による増加と、研究開発費等の支出による減少を合わせたものです。資産合計は29億4,100万円となっています。
一方の負債について、流動負債は8,300万円です。製造開発にかかる未払い金が減少したため、前期末と比べて1億2,500万円減少しています。
固定負債は5億1,700万円です。前期末と比べて1億2,900万円増えていますが、こちらは、AMEDのCiCLEの事業では毎年受領している補助金に対応して定期預金を預けており、これが長期預かり金としての増加分となります。
負債合計は6億円、純資産合計は23億4,000万円、負債純資産合計は29億4,100万円となっています。
自己資本比率は、前期末の76.6パーセントから少し増加して79.1パーセントとなり、引き続き健全な財政状態をキープしています。
無償減資について
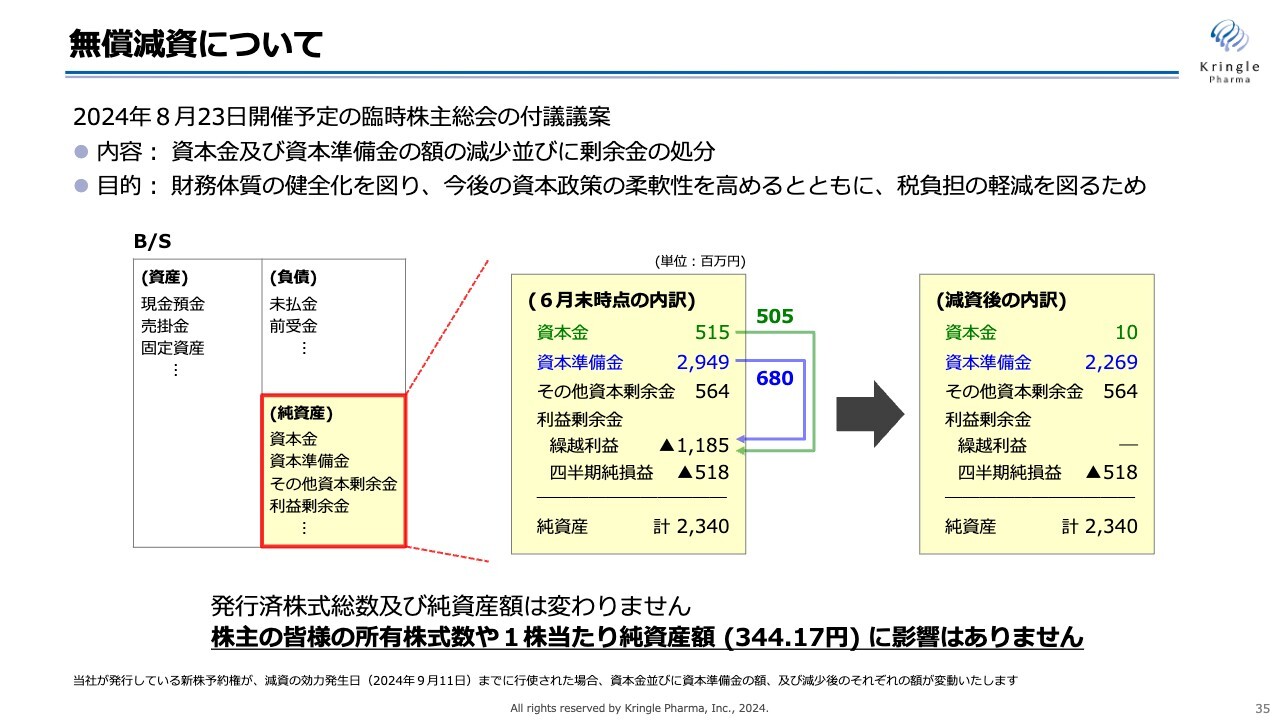
無償減資についてご説明します。こちらは、今月8月23日に開催予定の臨時株主総会において付議する議案です。
内容は、資本金および資本準備金の額を減少し、剰余金の処分に充てるというものです。目的は、財務体質の健全化を図り、今後の資本政策の柔軟性を高めるとともに、税負担の軽減を図るためです。
スライドには、B/Sの一部を記載しています。6月末時点で資本金は5億1,500万円、資本準備金は29億4,900万円となっていますが、このうち資本金を5億500万円減らし、さらに資本準備金を6億8,000万円減らします。
これらを合わせて、利益剰余金の繰越利益の欠損填補に充てます。
減資したあとの内訳は、スライドの右側に記載しています。資本金は1,000万円、資本準備金は22億6,900万円となり、利益剰余金の繰越利益が欠損填補でなくなることになります。
減資の前後で、純資産23億4,000万円および発行済み株式総数には変更はありません。したがって、株主のみなさまの所有株式数、あるいは1株当たりの純資産額にはまったく影響がありません。
6月末時点での株主のみなさまには、まもなく招集通知がお手元に届くと思います。ぜひご協力のほど、よろしくお願いします。
クリングルファーマのビジョン
私たちクリングルファーマのビジョンは、「患者さんに新薬を、人々に笑顔を」届けることです。
現在、当社は創薬バイオベンチャーですが、自らがバイオ製薬企業へと大きく成長することを目指しています。
まずは、再生創薬シーズHGFの社会実装です。現在は、脊髄損傷急性期での承認を取ることに全力を注いでいます。先ほどご説明したとおり、HGFの適用拡大を粛々と進めていきます。
また、中長期の飛躍的な成長には、海外展開をいち早く行うことも非常に重要になります。最終的にはHGFの次の新規シーズの開発にも着手し、私たち自身がバイオ製薬企業として患者さんに新たな価値を届けられるよう、全社を挙げて努力を継続していきます。
ご清聴ありがとうございました。
質疑応答:承認申請に使用するデータについて
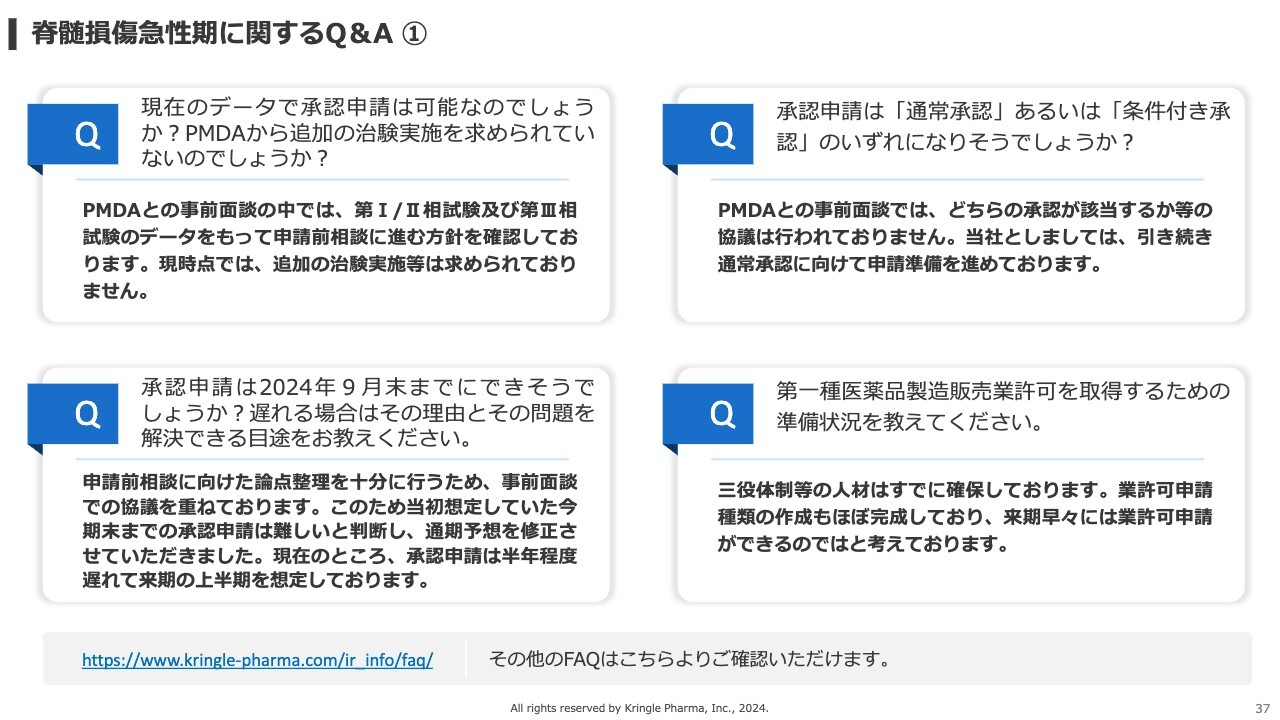
「現在のデータで承認申請は可能なのでしょうか? PMDAから、追加の治験実施を求められていないのでしょうか?」というご質問です。
PMDAとの事前面談では、すでに終了している第Ⅰ/第Ⅱ相試験および第Ⅲ相試験のデータをもって、次の申請前相談に進むという方針を確認しています。現時点では、追加の治験実施等は求められていない状況です。
質疑応答:承認申請の目処について

「承認申請は、2024年9月末までにできそうでしょうか? 遅れる場合はその理由と、その問題を解決できる目途を教えてください」というご質問です。
申請前相談において、論点整理を十分に行うために、PMDAの協議を重ねてきました。これまでは今期末までに承認申請をするという目標でしたが、当初想定していたよりも事前面談に時間を要したことから、承認申請が来期にズレるという見込みになってきました。したがって、現時点で承認申請は約半年程度遅れており、来期の上半期を想定しています。
質疑応答:承認申請の種類について

「承認申請は『通常承認』あるいは『条件付き承認』のいずれになりそうでしょうか?」というご質問です。
PMDAとの事前面談では、どちらの承認が該当するかなどの協議は行われていません。したがって、現時点ではどちらになるかということはお答えできませんが、当社としては引き続き、通常承認を前提に申請準備を進めていきます。
質疑応答:第一種医薬品製造販売業許可取得の準備状況について

「第一種医薬品製造販売業許可を取得するための準備状況を教えてください」というご質問です。
当社が脊髄損傷急性期の承認申請をするにあたり、第一種医薬品製造販売業許可を事前に取得する必要があります。こちらの業許可を取得するためには、社内にいわゆる三役体制を敷く必要があり、その他にも、人材を補充する必要があります。
こちらについては三役体制等の人材はすでに確保しており、業許可申請に必要な書類の作成も着々と進み、概ね完成しています。したがって、来期の早々には業許可申請ができるのではないかと考えています。
質疑応答:脊髄損傷急性期の欧米での共同開発パートナーについて
「脊髄損傷急性期の欧米での共同開発パートナー獲得の見通し、現在の交渉状況を教えてください」というご質問です。
脊髄損傷の第Ⅲ相試験のトップラインデータを公表後、製薬企業等からの引き合いが非常に増えています。当第3四半期にはアメリカの学会やシンポジウムに参加し、複数の会社との協議を継続して行っています。
こちらは守秘義務のもとで行っているため、交渉の詳細を開示することは憚られますが、契約が成立した際にはきちんと開示します。今しばらくお待ちいただければと思っています。
質疑応答:クラリス社との協業の状況について

続きまして、「HGFタンパク質製造の効率・拡大化に向けたクラリス社との協業の状況を教えてください」というご質問です。
クラリス社との守秘義務があるため詳細な回答はできませんが、すでに細胞株を作り、小スケールでの試作製造を複数回行っています。また、結果の解析を行っているという報告も受けています。
質疑応答:脊髄損傷第Ⅲ相試験結果の学会・論文発表の時期について

最後に、「脊髄損傷第Ⅲ相試験結果の学会・論文発表はいつ頃になりそうでしょうか?」というご質問です。
現在は総括報告書を取りまとめている最終段階にあり、適切な学会・論文発表ができるよう、治験にご参加いただいた先生方と協議を進めています。
このような学会および論文発表には審査があるため、確定しなければ開示はできませんが、確定した際にはきちんと開示します。
以上、脊髄損傷急性期に関するQ&Aをまとめてご回答しました。その他のよくあるご質問はサイトに掲載していますので、併せてご確認いただければと思います。
関連銘柄
| 銘柄 | 株価 | 前日比 |
|---|---|---|
|
4884
|
391.0
(12:37)
|
-4.0
(-1.01%)
|
関連銘柄の最新ニュース
-
今日 10:00
-
02/16 11:40
-
02/16 11:00
-
02/12 11:00
-
02/10 15:54
新着ニュース
新着ニュース一覧-
-
今日 13:38






