リボミック、「RBM-007」の軟骨無形成症第2相臨床試験で好結果 安全性の高さと投与頻度を利点に他社開発品との差別化を図る
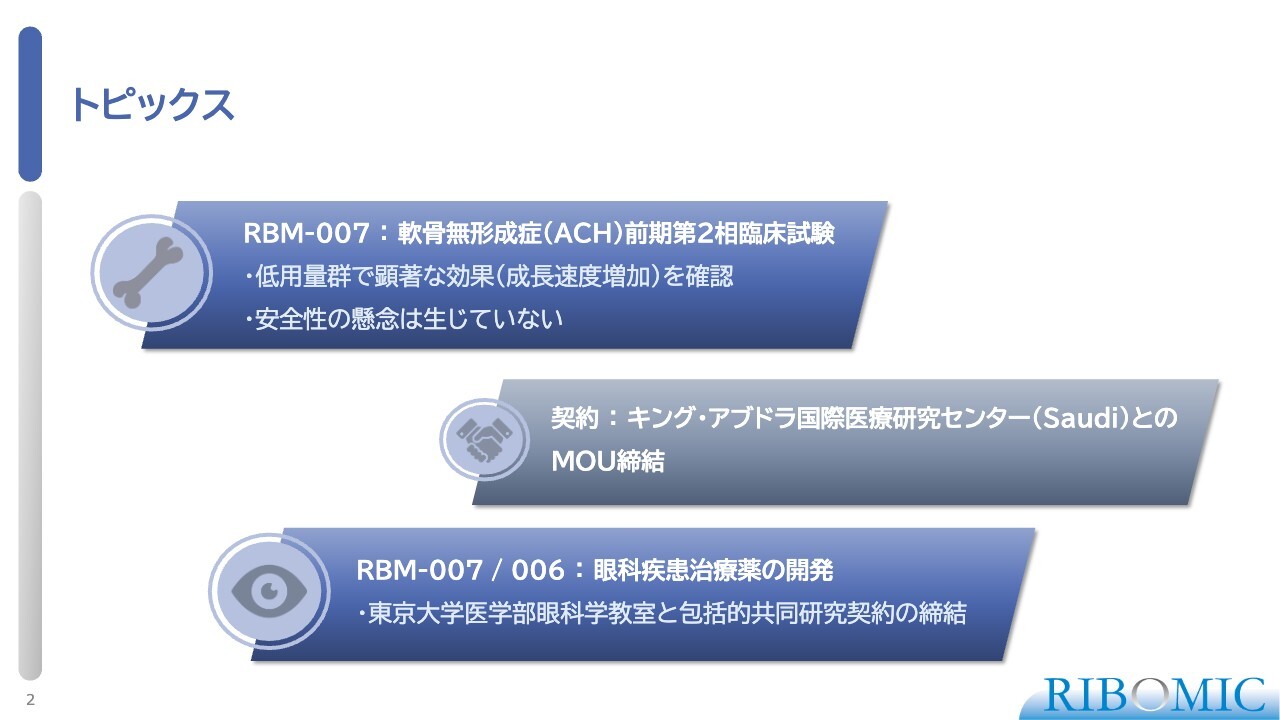
トピックス
中村義一氏:リボミック代表取締役社長の中村です。本日は2025年3月期第2四半期の決算説明会にご参加いただき、ありがとうございます。
スライドには、本日お話ししたいトピックスを3つまとめています。1つ目は、我々が進めてきた「RBM-007」という薬について、軟骨無形成症(ACH)に対する第2相臨床試験の最初の部分であるコホート1の結果が出ました。非常にすばらしい結果でしたので、そのご報告をします。
2つ目として、私は先週サウジアラビアでのヘルスケアバイオテクノロジー関係の国際会議に招聘され、参加してきました。その際に、キング・アブドラ国際医療研究センターとMOUを締結しましたので、ご報告します。
3つ目は、当社が進めている眼科疾患治療薬の開発における新しい試みとして、東京大学医学部眼科学教室と包括的共同研究契約を結びました。これをもって「RBM-007」および「RBM-006」の新しい眼科疾患の治療法を探索していく予定です。
本日の内容

本日は、スライドに記載のアジェンダに沿ってご説明します。
損益計算書の概要
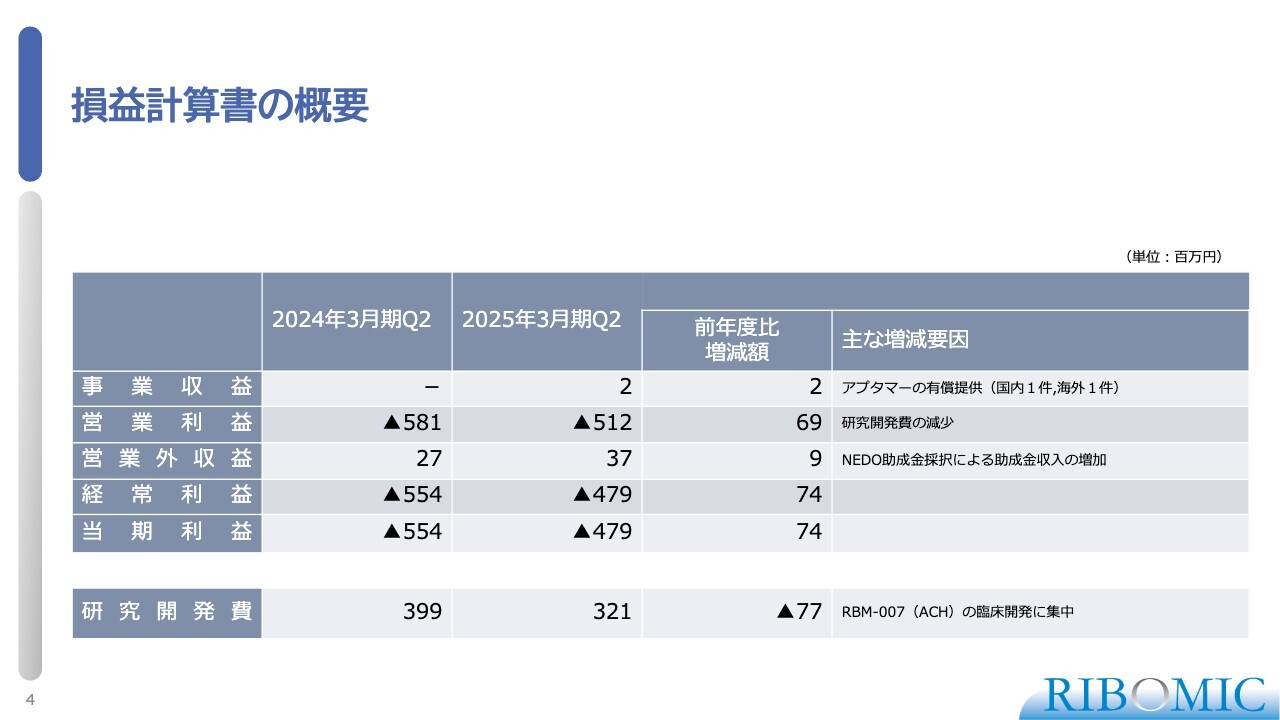
財務諸表に関しては、スライドに損益計算書を示しています。ご覧いただくとわかるように、当社が予定していた予算どおり順調に進んでいます。
貸借対照表の概要
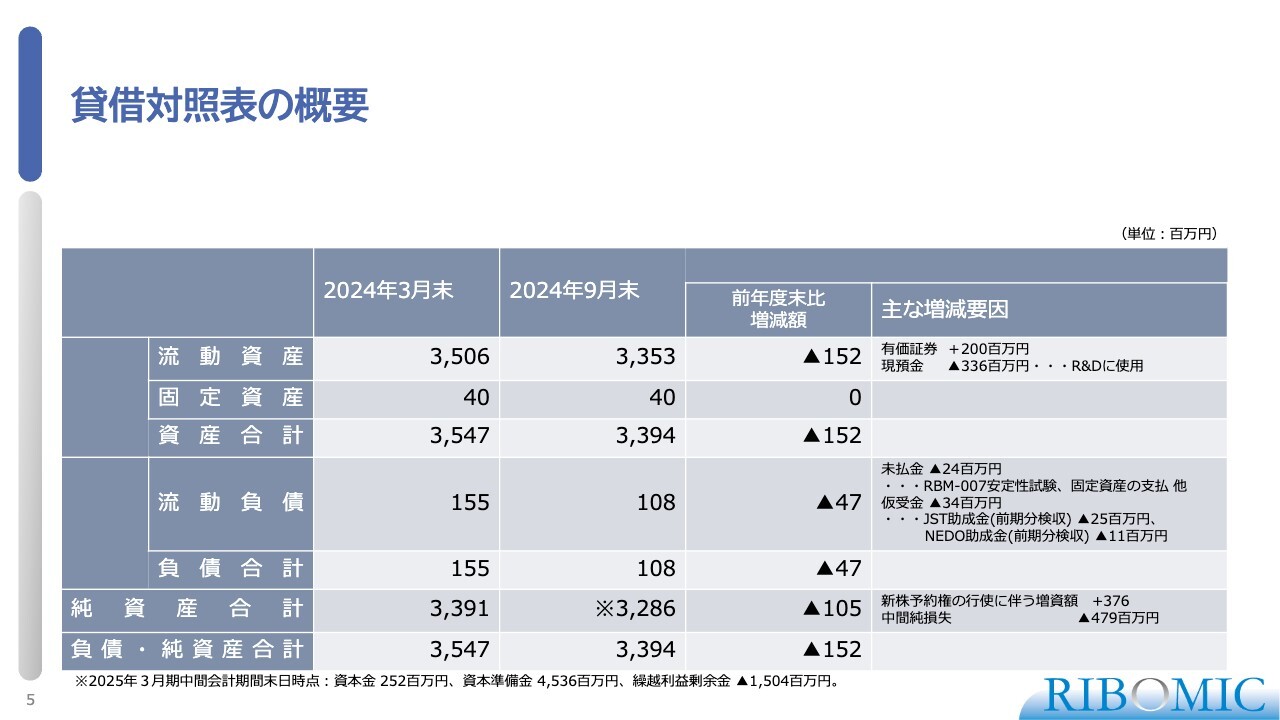
貸借対照表についても同様に大きな変動はなく、予定どおりに進んでいます。2024年9月末で約33億円の手持ち資金がある状況ですので、十分に事業を進めていけるということに変わりはありません。
資金調達

今年3月に第17回新株予約権を発行しました。SMBC日興証券が割当先となって進めていますが、現在までに約60パーセントを行使し、現金で4億3,000万ほどを調達しました。残りの40パーセントは、できるだけ速やかに行使を進めたいと考えています。
公的研究助成金

公的資金に関しては、スライドに2例記載しました。当社が進めているAIを使用した新しいアプタマー創薬技術が、JSTとNEDOから非常に高く評価されています。
それにより、JSTからは1年延長を認められ、NEDOからは量子コンピュータを使った新しい取り組みも非常に高く評価されて後期ステージに進んでいます。このように大変高い評価を受け、財務支援もいただいています。
2025年3月期 国際学会講演

事業内容についてご説明します。今期上期は、いくつかの国際学会に参加しています。
1つ目の国際学会は、米国のRetina Societyが毎年行っている年次総会です。そこに申し込んだ我々の演題が登壇発表に採択され、かねてから進めている「RBM-007」を使った加齢黄斑変性症の治療薬に関して、PoCが取れたという発表をしました。非常に好評だったと思います。
2つ目は、その直後にマドリードで開催された、骨の形成不全に関する国際会議です。こちらでも口頭発表することができ、現在進めているACHの臨床試験についてご報告しました。
3つ目は、サウジアラビアの国家プロジェクトとして進んでいるRiyadh Global Medical Biotechnology Summitです。先週開催された国家プロジェクトとしてのサミットに招聘いただき、私もサウジアラビア・リヤドへ行ってきました。
会議1ヶ月前の10月12日に突然、サウジアラビア国家警備保健省大臣であるバンダル・アルカニウィ閣下が当社を訪問されました。閣下は、サウジアラビアの国立大学であるキング・サウード・ビン・アブドゥルアジーズ大学の学長も兼ねていますが、実はサウジアラビアのムハンマド皇太子が進めている「2030年までに中東地域の保健医療の中心になる」という「ビジョン2030」の一環として、国際会議のサミットを行っています。
どうしても私をそこに招聘したいということで、閣下が直々に当社へ訪問されました。いろいろとお話をうかがい、私もそれをお受けすることにして、先々週からサウジアラビア・リヤドへ行ってこの会に出席しました。
突然のご訪問でしたが、閣下はおそらく王族の一員であり、政府の非常に重要な地位の方です。サウジアラビアがバイオテクノロジーを推進する上で、アプタマーが今のサウジアラビアの国情に非常に適したテーマだということや、サウジアラビアは臨床試験を行うための非常によいセンターを作ったため、そちらで当社の臨床試験をしてもらえないかという気持ちでいらしたようです。
そのようなお話を聞いて、我々もまずリヤドに行ってみようと考え、行ってきました。
キング・アブドラ国際医療研究センター(Saudi)とのMOU締結

そのサミットでの私の基調講演とワークショップでの講演も終了し、キング・アブドラ国際医療研究センターとMOUを締結しました。このセンターは2006年に開設された非常に近代的な施設で、テクノロジーの研究のみならず、臨床試験もフルにできるような最先端の施設として作られています。
このMOUは、我々のアプタマーをそこでの研究として導入し、臨床試験も行ってほしいという目的があります。また、もし我々がリヤドでの臨床試験に合意すると、非常に大きな財政的支援が期待できるというお話もうかがいました。
このようなお話を有効に使いながら、中東地域での展開も考えていきたいと思っています。
飛躍する核酸医薬:アプタマーもそのひとつ
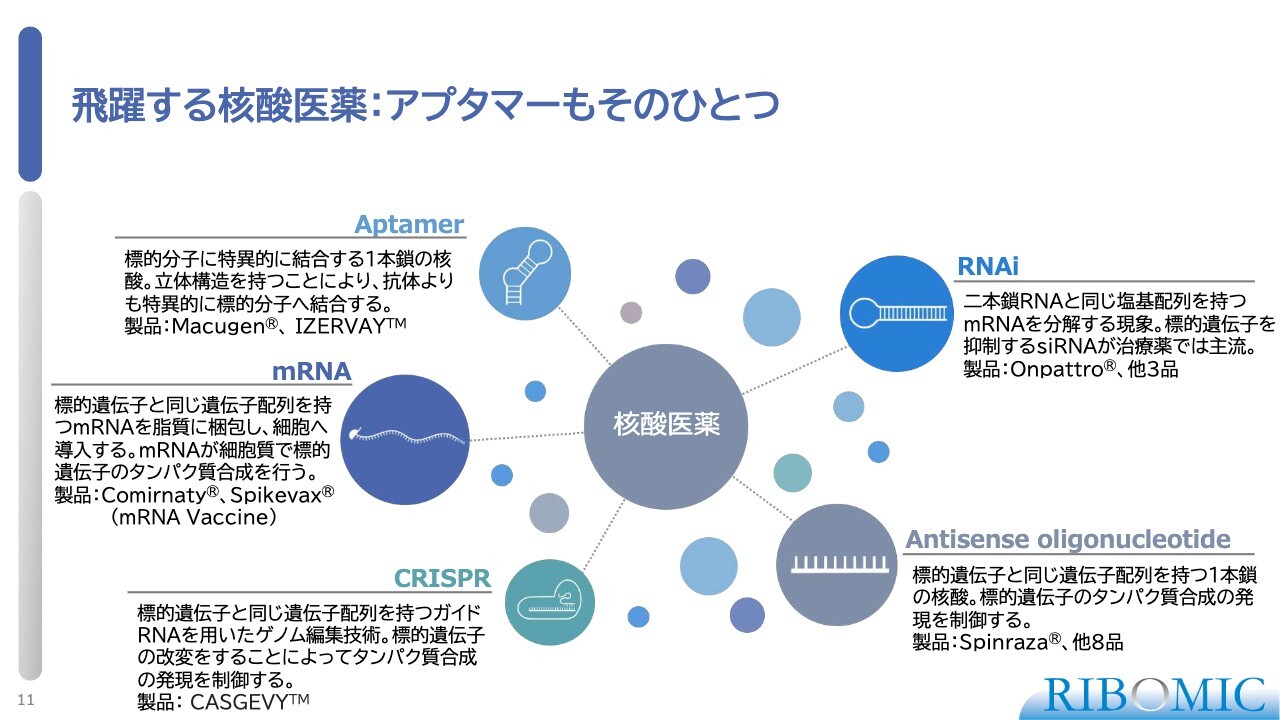
みなさまもご承知のように、核酸医薬は非常に大きな展開が進んでいます。当然ながら、一番クラシカルなアンチセンスオリゴヌクレオチドを使った医薬品開発も非常に進んでいます。
そのほか、RNAiを使った新薬やCRISPRを使った薬、新型コロナウイルスワクチンのmRNAを使った医薬品開発、そしてアプタマーというかたちで、非常にいろいろな特徴を持った核酸医薬の開発が臨床ステージに進んでいます。
アプタマー(Aptamer)とは?

こちらのスライドは何度もお見せしていますが、我々が扱っているアプタマーは、比較的短い1本鎖の核酸が配列に応じてさまざまなかたちを作り、さまざまなタンパク質にジャストフィットし、その働きを阻害するのが特徴です。
スライドに示しているのは白色の酵素で、腺症の原因になるオートタキシンというものです。そこに非常に小さな29の1本鎖の核酸が非常に特徴的な立体構造を作り、がっちりと組み込んで阻害するというメカニズムになっています。
このような核酸医薬品は、スライドに示しているように、抗体に比べていくつもの利点があります。我々はこれを利用して、医薬品の開発を進めていきたいと考えているところです。
当社の重点領域

当社が狙う疾患についてご説明します。1つ目は、スライド右側に記載の希少疾患です。大手がなかなか開発に踏み切れないような、患者数は少ないものの非常に難しい疾患に対して、我々のアプタマー技術を使って開発することをテーマとしています。
2つ目は、スライド左側に記載の目の病気、特に網膜疾患です。目は閉鎖系器官ですので、そこに注射しても全身には流れ出ません。したがって、安全性が担保されています。また、非常に小さな器官ですので、注射して投与する量も少なくて済むというメリットがあります。
そのような意味で、我々は希少疾患と網膜疾患をアンメットターゲットにして開発を進めています。
主要なパイプライン
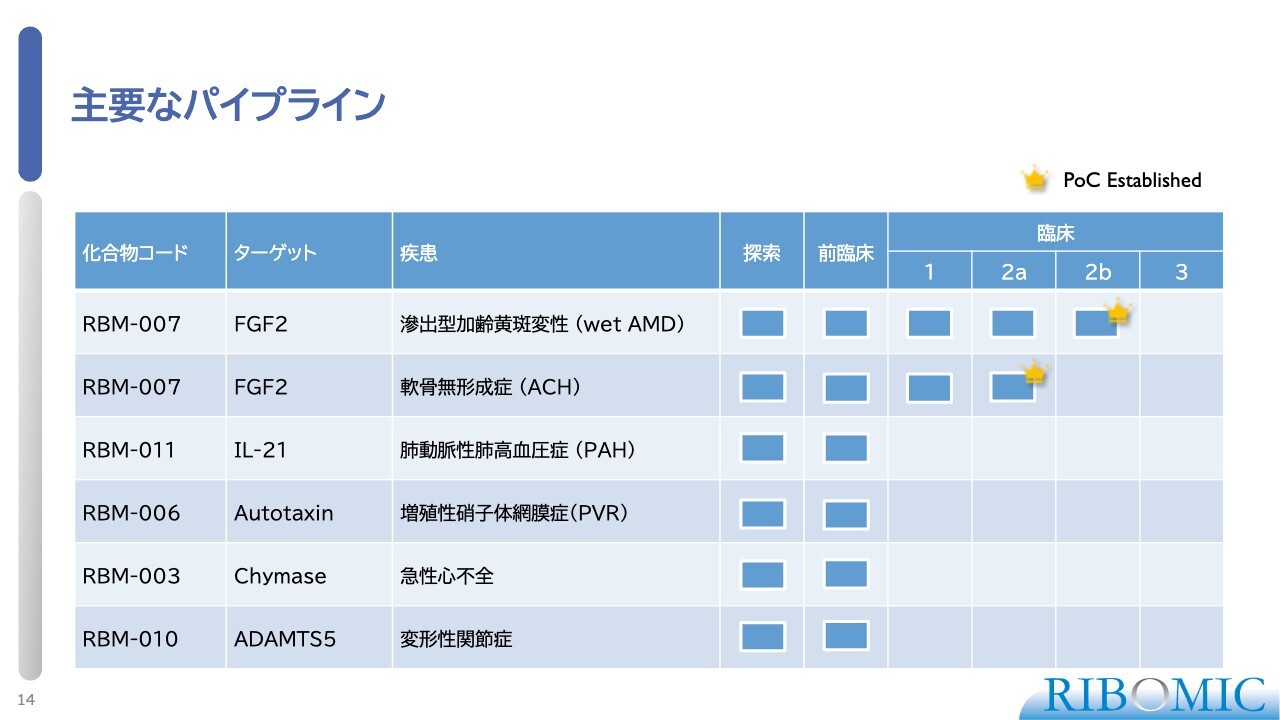
現在フロントで進めているのは、我々のコード番号「RBM-007」です。これはFGF2(線維芽細胞増殖因子2)をターゲットにしたアプタマーで、臨床開発を進めています。
一番進んでいるのは、スライド1行目に記載している滲出型加齢黄斑変性症(wet AMD)です。こちらはすでに米国でフェーズ2の臨床試験を終えており、我々が期待したとおり、薬が人の体内(目)で働いて効果を示すことを証明できました。要するに、PoCを確立しているステージだということです。
2つ目は、本日詳しくお話しする軟骨無形成症(ACH)で、日本において第2相の臨床試験を進めてきています。今月初めに続報を開示しましたが、驚異的に大変よく効いているということで、薬としてもPoCを確立したと言っても差し支えないだろうと思っています。
軟骨無形成症(ACH, Achondroplasia)

軟骨無形成症を対象とした臨床試験についてご説明します。軟骨無形成症(ACH, Achondroplasia)とは、腕や脚の太い骨が十分に生育しないために低身長になる遺伝性疾患です。この病気にかかった成人男性の身長は約130センチメートル、成人女性は約124センチメートルしかなく、健全な両親から正常に生まれる2万5,000例に1人という頻度で発生する希少疾患です。
原因はよく研究されています。FGFに対するレセプターは4つありますが、そのうち3番目のレセプターFGFR3に1アミノ酸変異が起き、非常に活性化しやすいという特徴があります。外にそのFGFのリガンドがあると、すぐにそれが活性化してFGFR3からシグナルが入ってきます。
そのシグナルは骨の発育をブロックするブレーキの役割があるため、身長が伸びないということになります。FGFR3は、外にある主なリガンド、成長因子のうちFGF2がメインとなるリガンドであることがわかっていますので、我々の「RBM-007」を使えば、FGF2をトラップしてシグナルの流入を抑制できます。
そのようにすれば良いお薬になるだろうという考え方で、さまざまな実験を行いました。
研究成果:Science Translational Medicine 掲載

各種実験に関しては、数年前に米国のトップジャーナル「Science Translational Medicine」に報告をしました。大事なことは、我々が考えたセオリーが動物実験や細胞実験で証明されたことです。
我々は、理論的な裏付けが十分にできている状況のもとで、臨床試験を開始しています。
国内におけるACH 開発スケジュール
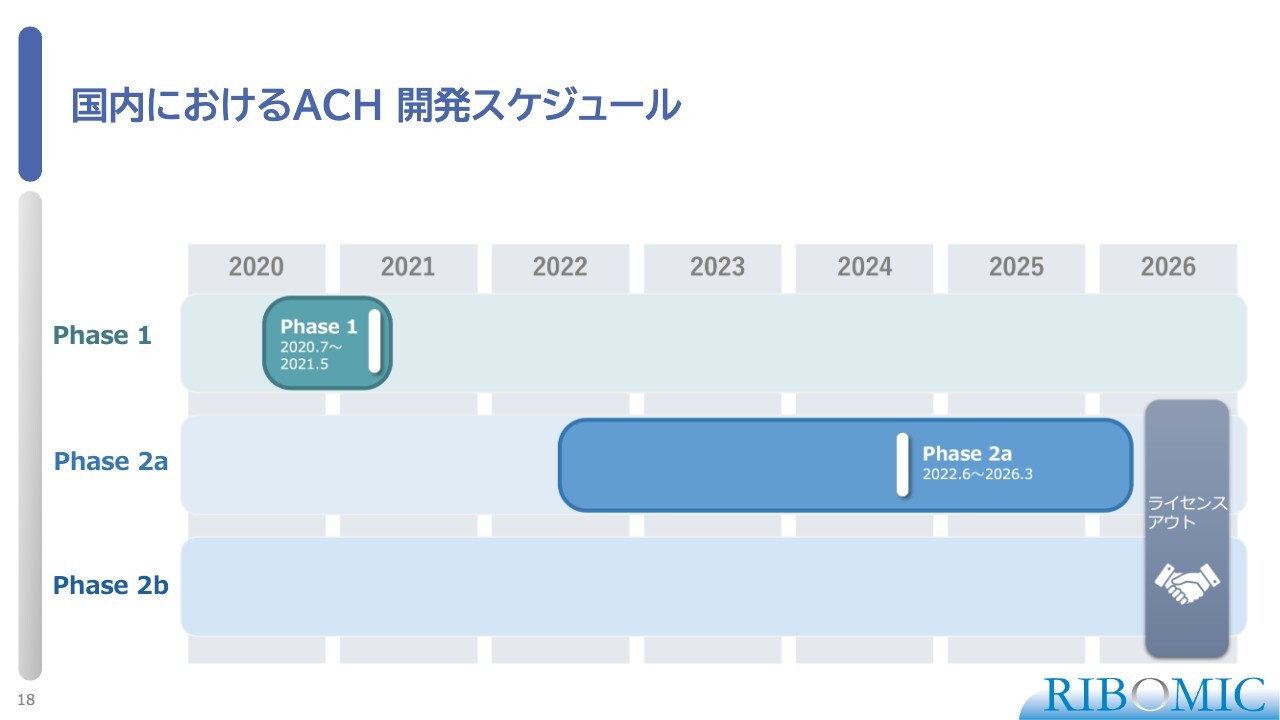
安全性と忍容性を調べるフェーズ1を終えて、現在はフェーズ2の第2相試験を日本で進めています。その第2相試験のパートを2つに分け、低用量の薬をコホート1、高用量の薬をコホート2として、それぞれを子どもの患者さまに注射するという試験を進めてきています。
Phase 2a 臨床試験デザイン
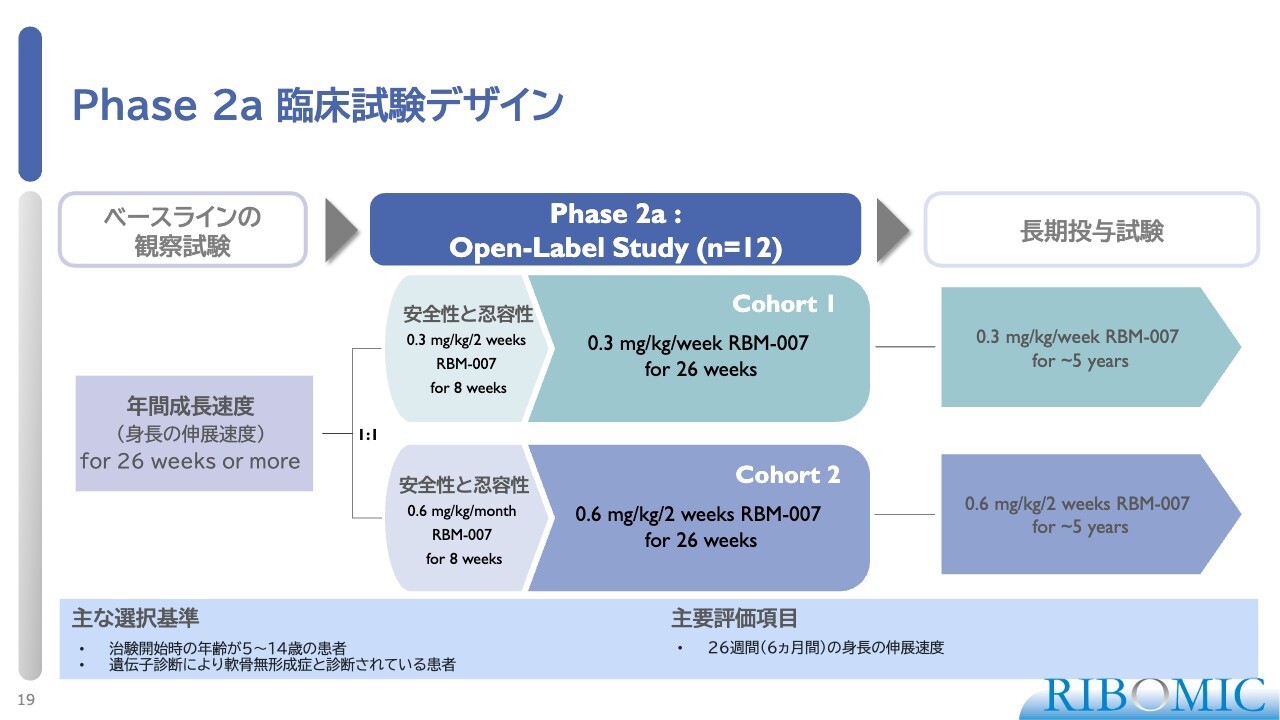
この試験の評価項目は身長です。身長の伸びがどうなるかが一番重要ですので、遺伝子診断で軟骨無形成症の変異が確かに入っている、5歳から14歳の子どもの患者さまにエントリーしてもらいました。
実際の投薬前に、まずはベースラインの観察試験として、薬なしで半年間の身長の伸び具合を測り年間成長速度を調べます。それが終わると、患者さまをコホート1とコホート2の2群に分けます。
コホート1では、体重1キログラムあたり0.3ミリグラムという低用量で、1週間に1回の皮下注射を半年間行って伸び具合を調べます。それが終われば、約5年間の予定で延長試験を行います。コホート2では、体重1キログラムあたり0.6ミリグラムという2倍量で、同じように試験を進めます。
最初の半年間が終わったところで年間成長速度がどれぐらいアップするかが、非常に大事な評価項目になります。
Phase 2a 臨床試験の進捗
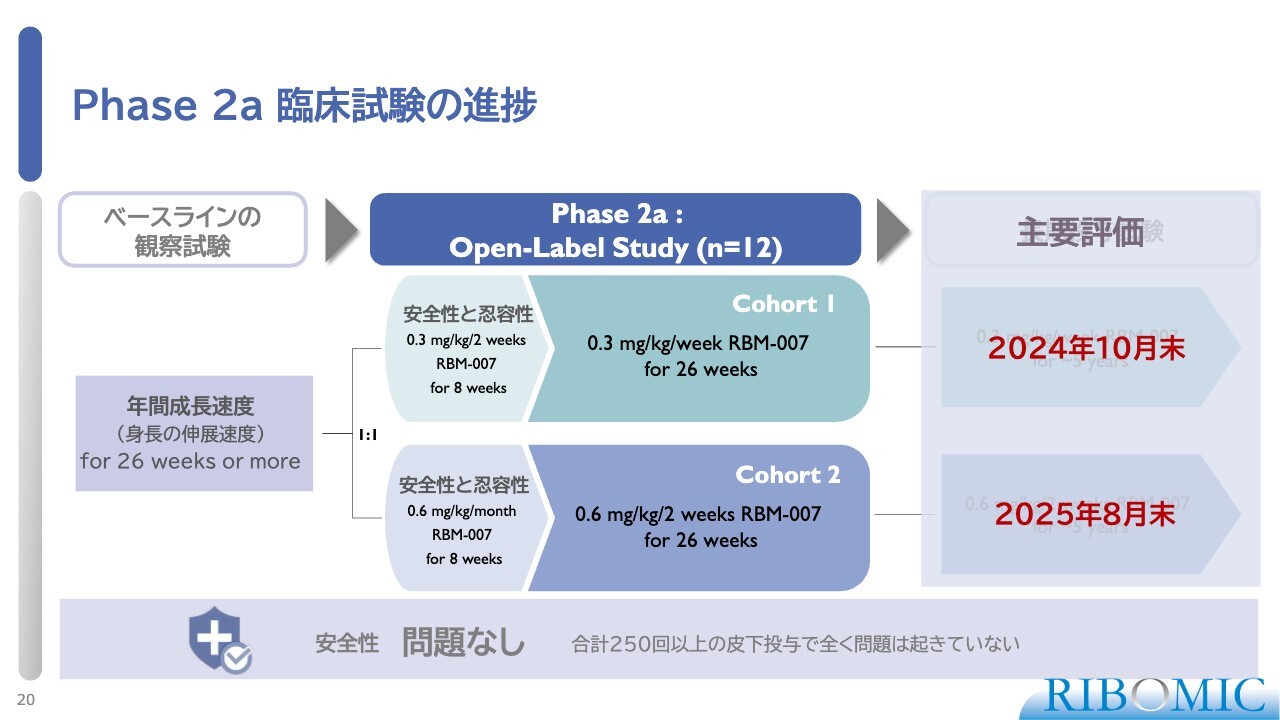
コホート1は10月末に完了したため、本日はそちらについて詳しくお話しします。コホート2は来年8月に完了する予定です。幼い子どもに合計250回以上の皮下注射を行っていますが、これまで安全性の問題はまったくありません。
Phase 2a Cohort 1 結果と他剤との比較
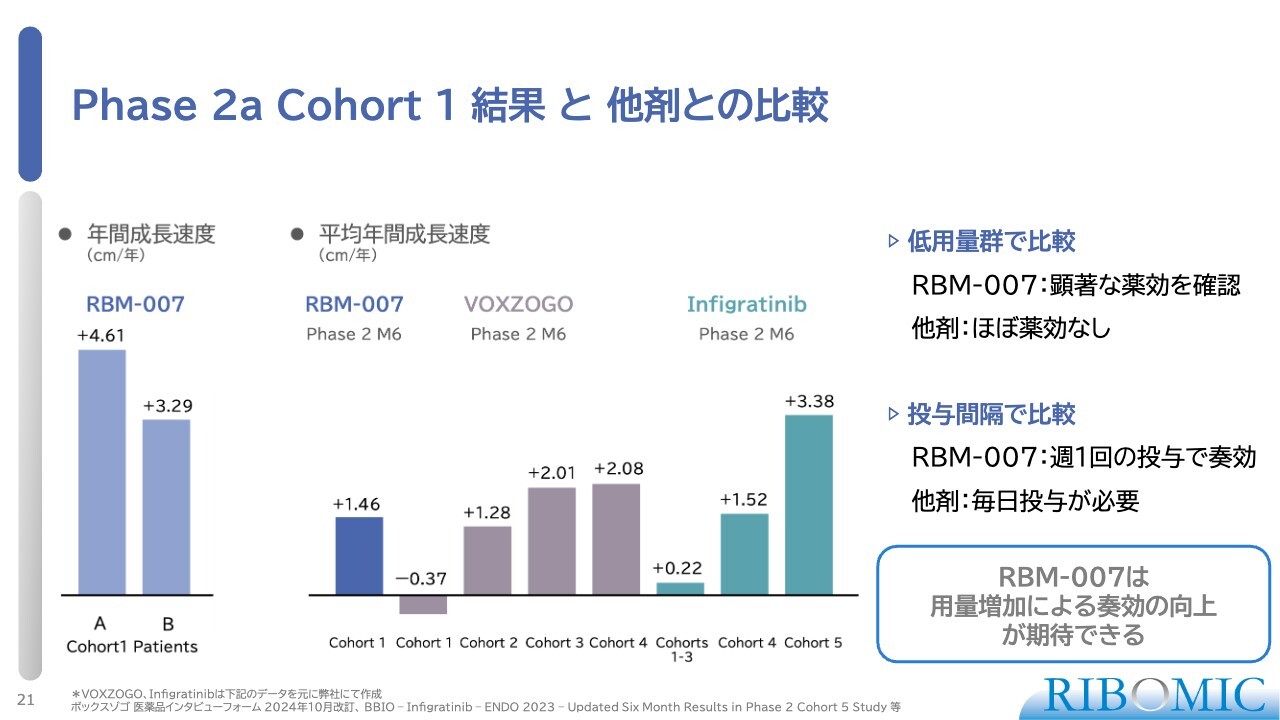
スライドには、今月初めに速報として開示した実際のデータを掲載しています。スライド一番端側のグラフは「RBM-007」の効果を見たものです。
6名の患者さまのうち1名は途中休薬が長いため、試験からは一応除外しました。これは安全性の問題ではなく、非常に小さな子どもですので数ヶ月間の注射をしない時期が入ったためです。したがって、残り5名の患者さまが半年間の皮下注射による投薬を完了しました。そのうち3名は変化量が比較的小さく、少しは伸びている患者さまもいますが、あまり顕著ではなかったです。
我々が注目したいのは2人の患者さまです。スライドにも2人分書いていますが、1人は1年でプラス4.6センチメートル増加しました。もう1人はプラス3.3センチメートル増加しました。このような2人の患者さまが非常に反応しました。これは非常にすごいことだと思います。
先ほどお話ししたとおり、この疾患の患者さまは成人男性でも130センチメートルほどまでしか身長が伸びません。もし、プラス4.6センチメートル伸びる薬を10年間注射し続けると、10年間で46センチメートル上乗せで伸びます。そうすると170センチメートルまで到達します。
同じように、3.29センチメートル伸びた患者さまも、だいたい150センチメートルから160センチメートルの身長になります。つまり正常な方と同じ身長になるということで、これは本当にすばらしい効き目だと思います。
当然ながら、効かなかった患者さまにはなんらかの理由があるものと思いますが、我々は量を増やしていけば必ず効くという確信を持っています。この5例を平均すると、1年間の成長速度がプラス1.46センチメートルという数字です。
実は今、日本ではBioMarin Pharmaceuticalの「VOXZOGO」という承認薬がACHの子どもの患者さまに使われています。こちらも毎日皮下投与する薬ですが、高濃度の適応まで全部試験した後の値で、平均プラス1.7センチメートルです。
ここでお伝えしたいのは、我々の試験はコホート1、つまり一番低用量の薬でこれだけの効き目が顕著に出ているということです。「VOXZOGO」というお薬は低用量では効かない状態ですので、我々のお薬には非常に強い潜在力があると言えます。
また、もう1つの競合品として、BridgeBio Pharmaが開発した「infigratinib」があります。こちらはFGFR3に作用する抗がん剤で、すでに成人のがんに使われている薬です。低用量・中用量での試験において低用量では効かないのですが、用量を増やすとそれなりの効き目が出るかたちで反応しているため、当社にとってはやはりこれらが競合品になると考えています。
そのような競合状況の中、一番低用量で効いたのは非常にすばらしいデータだということで、我々はそれを喜んでいます。加えて、投与間隔についても、我々の薬は1週間に1回です。「VOXZOGO」と「infigratinib」は毎日ですので、そのような利点があります。
したがって今後、コホート2の実験を含めて用量を増やしていけば、我々の薬はもっと強い効き目を実現できるだろうと考えています。
治験薬の奏効率
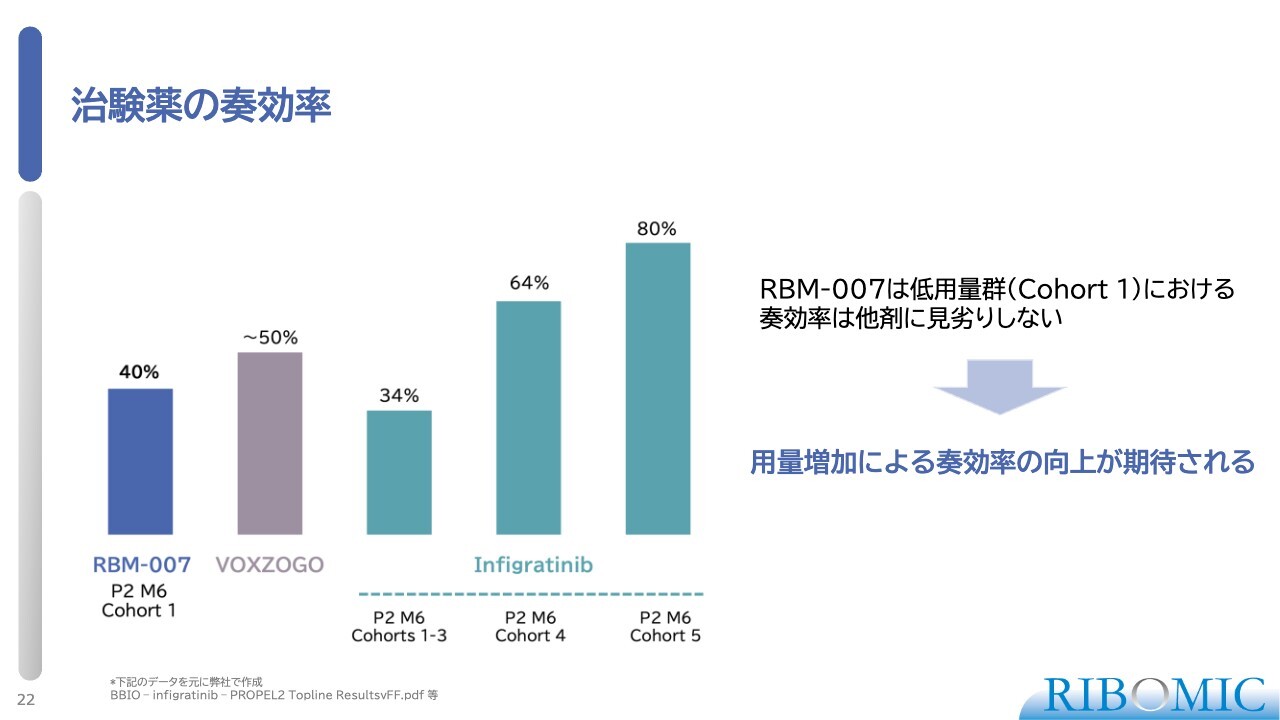
治験薬の奏効率、つまり「何パーセントぐらいの子どもに効くのか」についてご説明します。我々のデータでは、低用量で実施した時に、5人中2人に顕著に効いています。先ほど「3人は反応しなかった」と言いましたが、3人のうちの1人は若干の反応があったものの、それを差し引いて40パーセントの奏効率です。
BioMarinの「VOXZOGO」は製品化して市場に出ていますが、奏効率は50パーセントです。「infigratinib」は、量を増やしていくとそれなりに奏効率は上がるというデータがあるため、我々の薬もこれから量を増やしていけば、奏効率も効き目もずっとアップするだろうと現状では考えています。
今後の方針
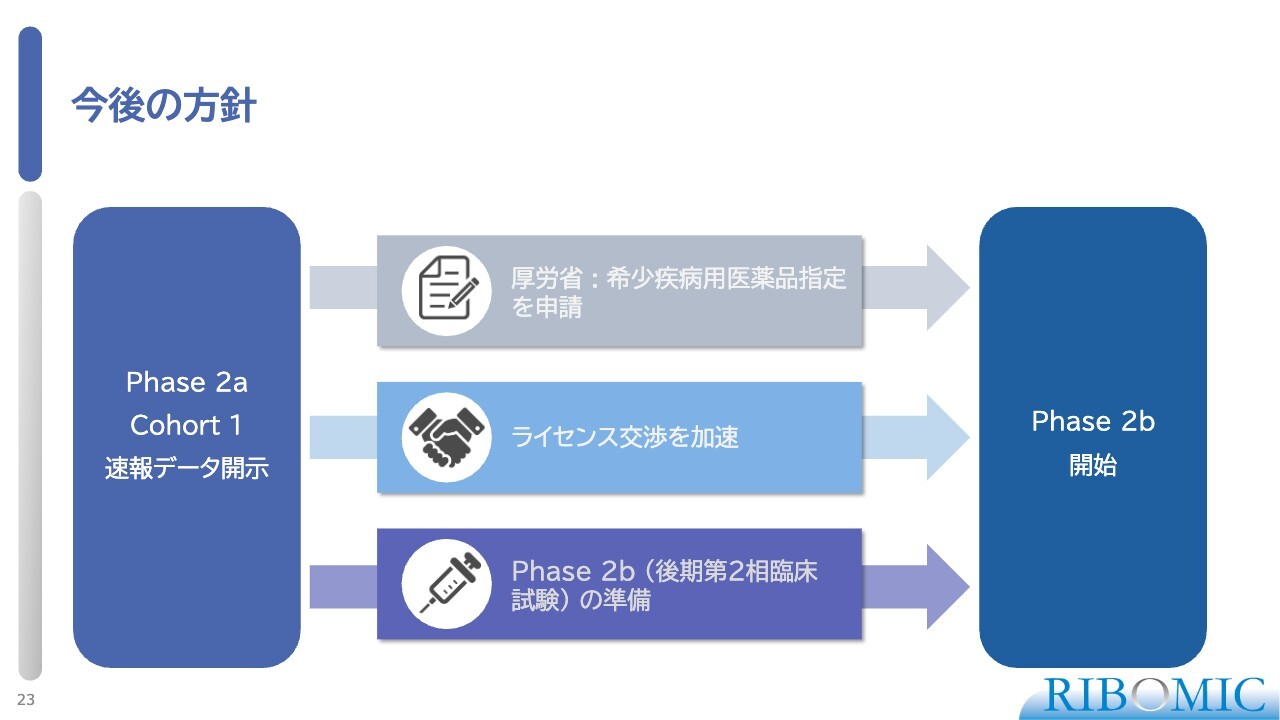
今後の方針についてご説明します。コホート1で非常に良い結果が出たため、厚労省のオーファンドラッグ申請を進めたいと考えています。すでに当局と何度も話し合いを重ねているため、我々としては速やかにオーファンドラッグの申請許可が出るのではないかと考えています。
同時に、現在のステージにおいて、この薬に非常に強い興味を持つ会社が国内外に多数あるため、積極的に話し合いを進めているところです。どこかのタイミングで、パートナーとして共同で進めるか、ライセンスアウトするかという方向を選んでいきたいです。
1つお伝えしたいこととしては、コホート1で非常に良いデータが出ており、コホート2ではもっと良いデータが出ると期待しています。このデータをもとに、当初計画していたフェーズ2の後期試験であるフェーズ2bをスキップして、承認申請に必要な第3相試験にそのまま入れる可能性が出てきました。
こちらについては、規制当局と相談して指導を得ながら、第3相試験に直接踏み切れるかどうかを進めていきたいと考えています。
他社開発品との差別化
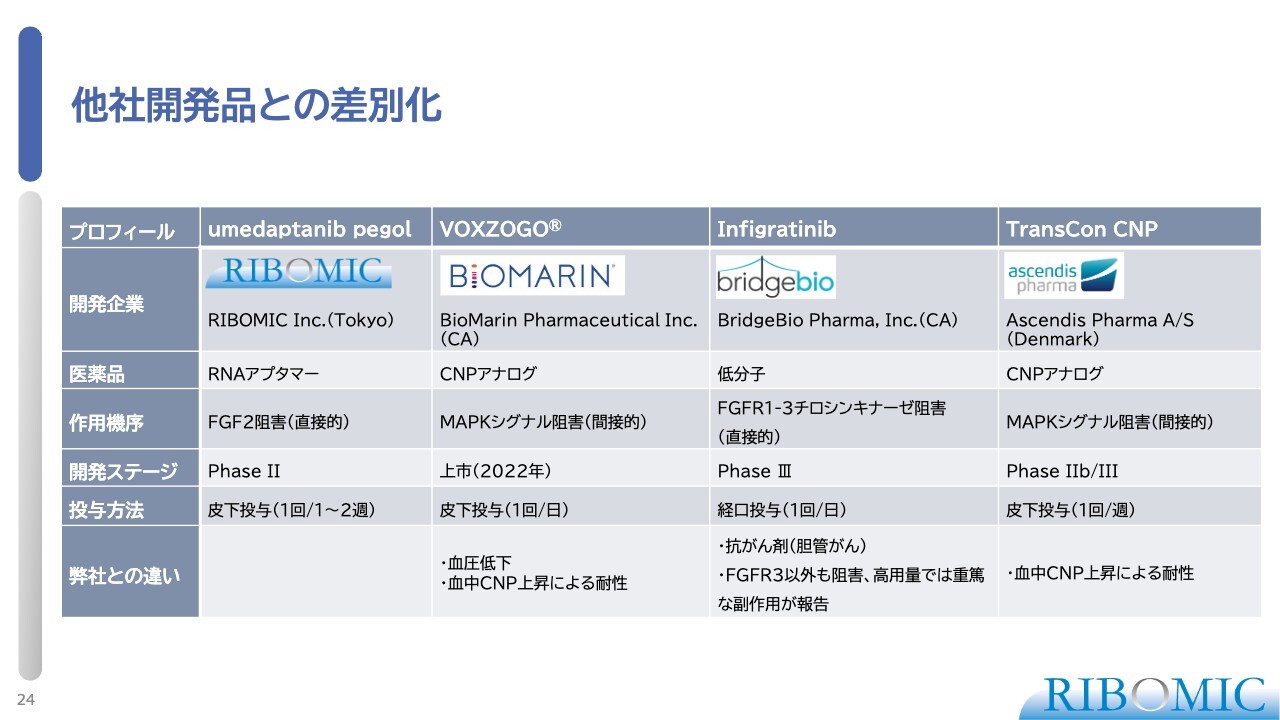
こちらのスライドは、他社製品との比較です。大事なことはすでにお話ししましたが、各社各様の薬になっており、BioMarinの「VOXZOGO」は1日1回の皮下注射が必要です。
同じ薬剤の「TransCon CNP」は、徐放性にすることで1週間に1回の注射でよいとしていますが、CNPであることには変わりません。そのため、年間成長速度はプラス1.6センチメートルから1.7センチメートルほどです。
それに対し、BridgeBioの抗がん剤「Infigratinib」は「TransCon CNP」よりも強いです。第3相試験の一番直近のデータを見ると平均2.5センチメートルほど伸びる薬ですが、やはりいくつかの懸念点も指摘されています。
抗がん剤のため、やはり副作用が出てくる危険性があります。特に小さな子どもに、幼若の時から長ければ7年から8年、毎日抗がん剤を服用しなければいけないため、どのようなことが起きるかを非常に懸念する臨床医もたくさんいます。
その中で我々の薬は、非常に安全性が高いことと1週間1回の投与で済むことが利点です。投与方法については、フェーズ2の結果によっては2週間に1回の皮下注射で済むこともあり得るのではないかと考えています。
世界におけるACH治療薬の市場
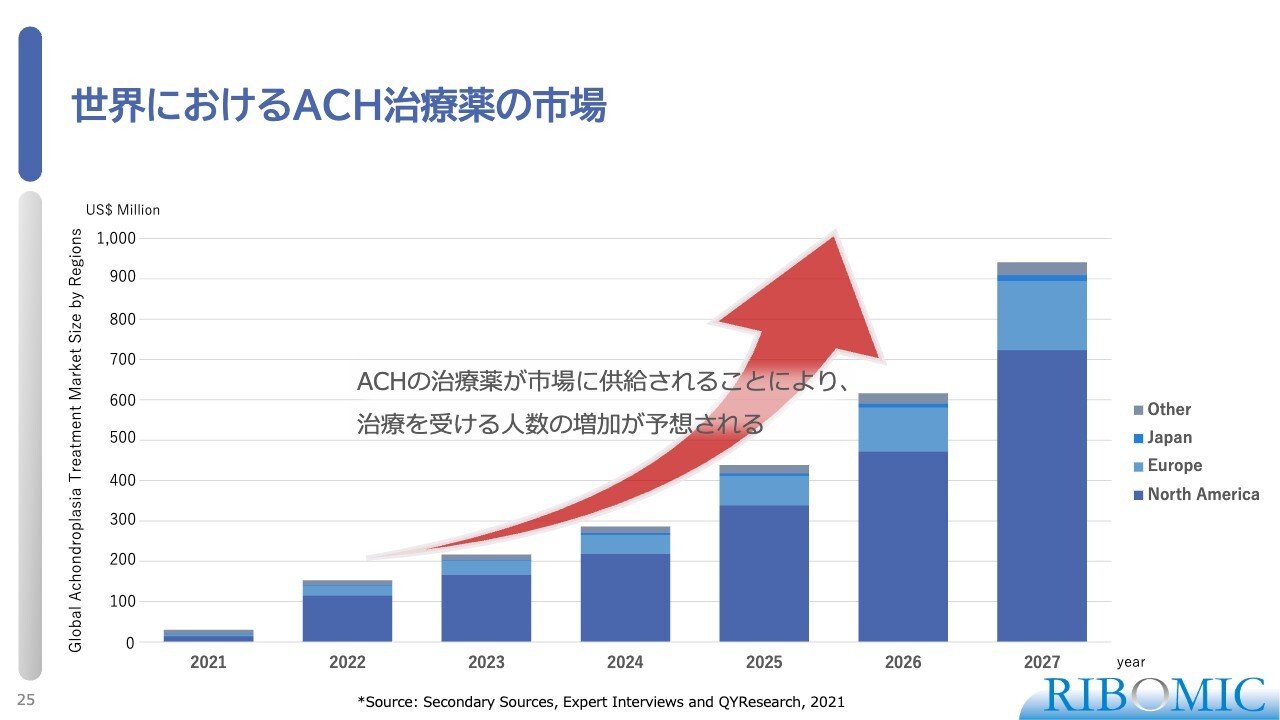
スライドのとおり、新しい薬が出てくるとマーケットも非常に大きく拡張していきます。我々もそちらに大変期待しながら、進めていきたいと考えています。
第二のアプタマー医薬品 IZERVAY

こちらも我々がかねてより進めている、網膜疾患治療薬の臨床開発についてご説明します。
アプタマーを使った医薬品の中では、2023年に第2のアプタマー医薬品「IZERVAY」が、IVERIC Bioという米国の会社から開発されました。これは補体因子C5を阻害するアプタマーで、疾患はdry AMDです。dry AMDに対して有効だということが臨床試験で承認され、2023年にFDAが了承し、薬として上市されました。
そして、2023年にアステラス製薬が8,000億円の巨費を投じてIVERIC Bioを丸ごと買い取り、今はアステラス製薬の大主力製品に育てようとしています。これは我々にとっては、アプタマーが薬として認められたという2つ目の事例になるため、非常にウェルカムです。
世界におけるアプタマー医薬品開発の動向
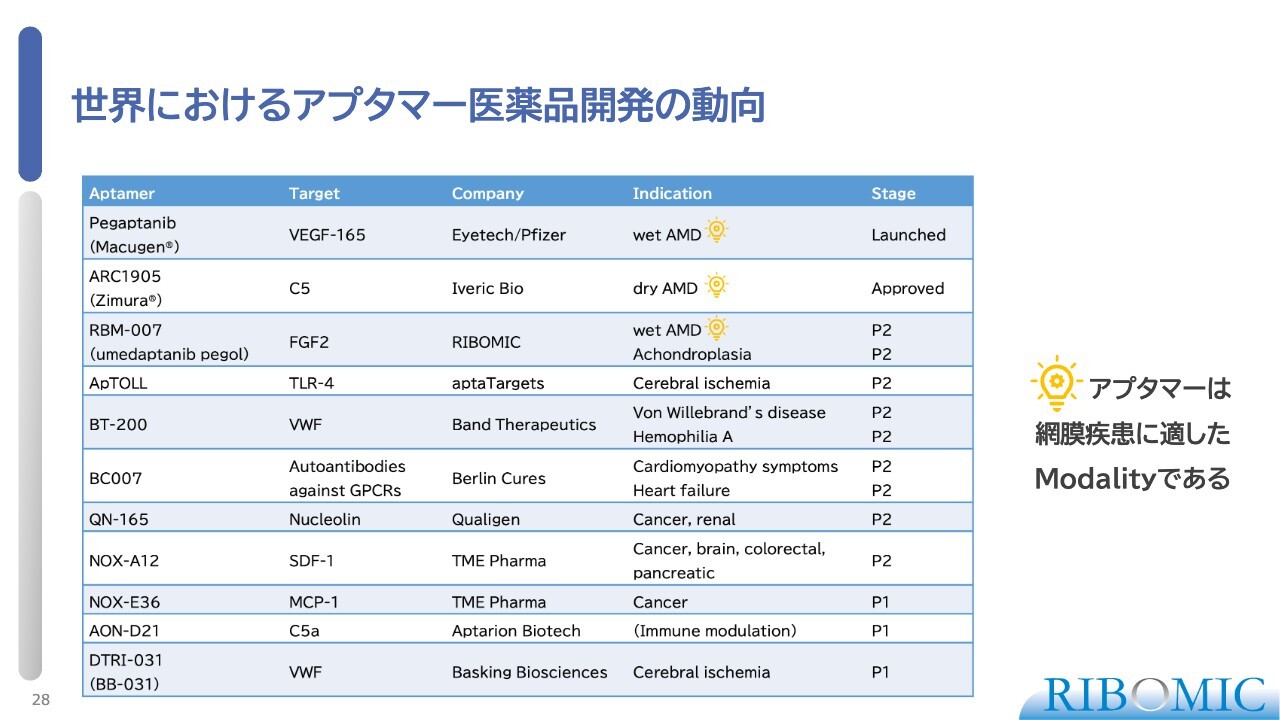
世界におけるアプタマー医薬品の開発についてご説明します。2003年に初めて米国で承認されたアプタマーが、wet AMDに対するVEGF阻害剤の「Macugen」です。その後20年間、第2のアプタマー医薬品が出てこなかった中で「IZERVAY」が出たということで、我々は非常に勇気付けられています。
そして、当社のFGF2に対する阻害剤「RBM-007」が、wet AMDにおいてPoCを証明できたことも非常に明るい材料です。このように、我々はいろいろなかたちで非常に勇気付けられながら、アプタマー医薬品開発を進めています。
拡大する網膜疾患の市場
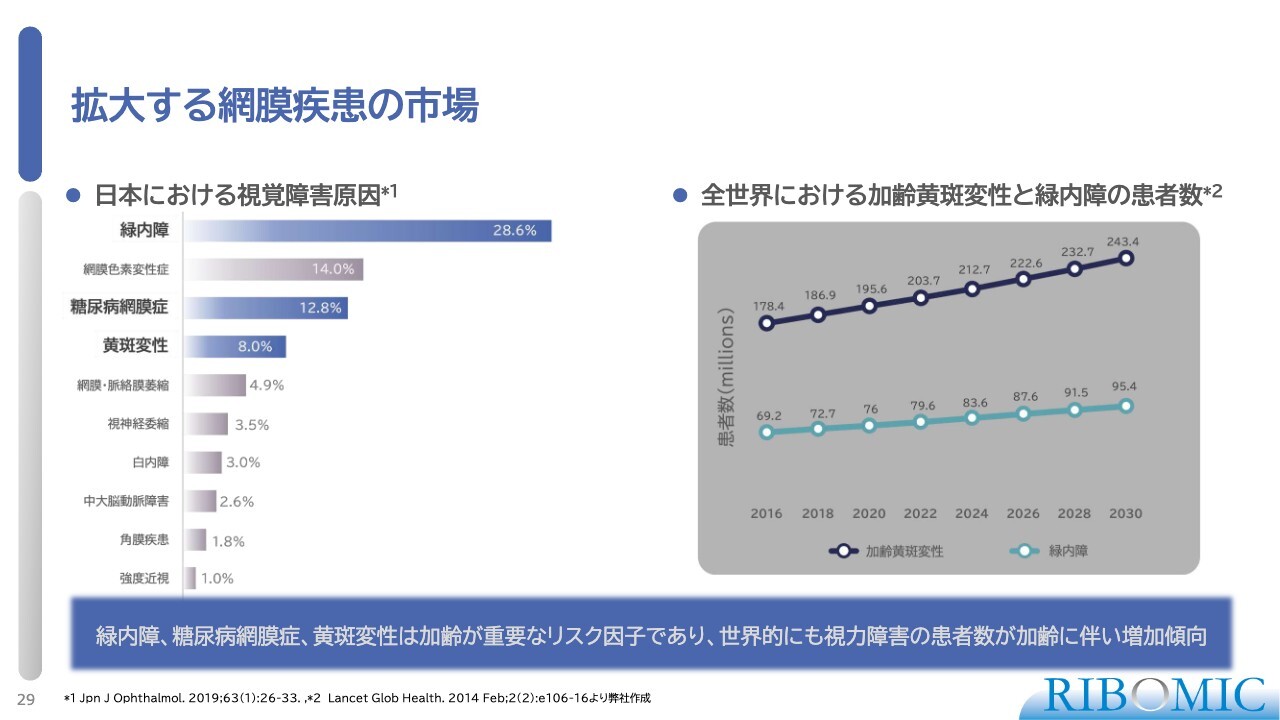
スライドに記載のとおり、日本における網膜疾患の患者数は緑内障が一番多く、黄斑変性は4番目です。しかし、加齢とともに網膜疾患を含めた目の病気が非常に増えてきます。特に世界的に見ると加齢黄斑変性症が非常に増えており、緑内障も増加しています。
つまり、加齢とともにそのような人口は増えるため、どうしても新しいタイプの有効な薬の開発が必要だと考えているところです。
RBMアプタマーの網膜疾患への適応
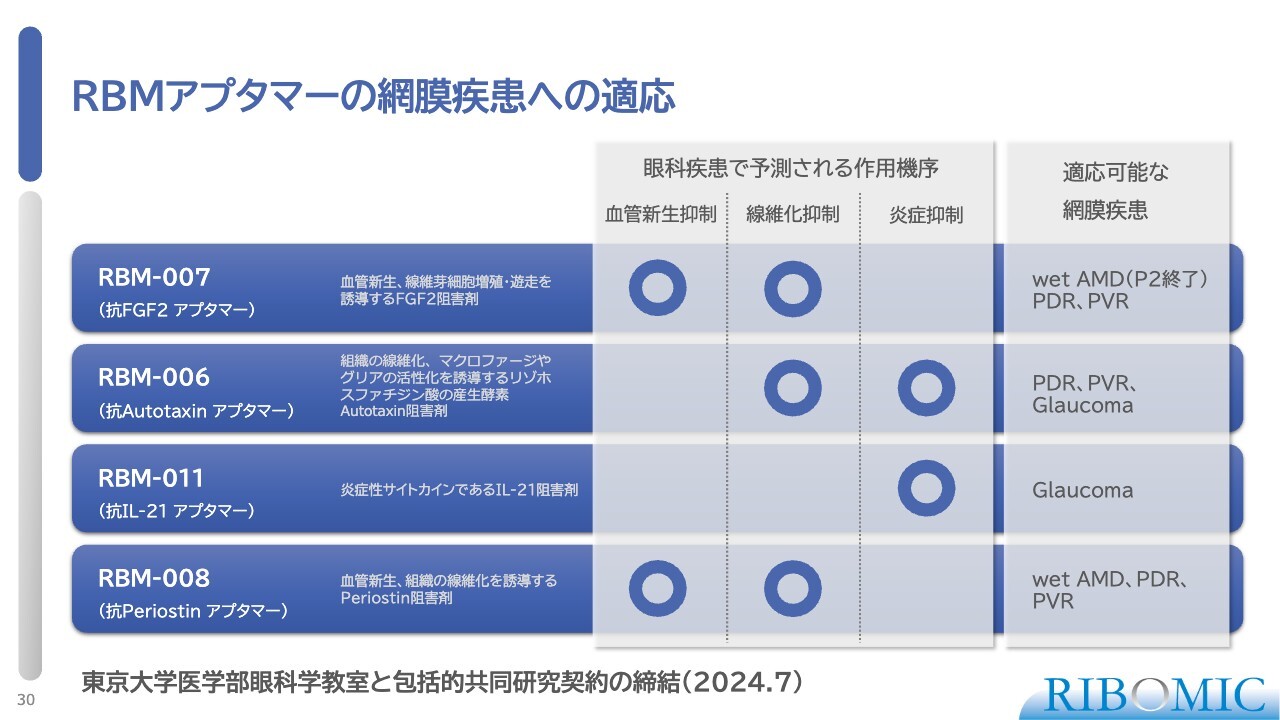
「RBM」というコードナンバーが付いた当社のアプタマーは、免疫系の主要因子あるいは成長因子をターゲットにした阻害性のアプタマーです。これらが免疫系に働き、網膜疾患などのいろいろな局所で効く可能性があります。
特に眼科疾患の原因として非常に予測されるのは、血管新生、線維化、炎症です。これらは目の奥のほうで起きますが、そのいくつかのステージを、我々のアプタマーがブロックできることがすでにわかっています。
そうすると、適応疾患としていろいろなものが考えられます。wet AMDだけではなく、非常に増えている増殖性糖尿病網膜症(PDR)や増殖性硝子体網膜症(PVR)、さらには緑内障(Glaucoma)などが大きなターゲットとなります。
これらの疾患、特に緑内障や糖尿病網膜症に関しては、東京大学医学部眼科学教室が精力的に研究しています。その中で我々は今年、東京大学医学部眼科学教室と2年間の包括的共同研究契約を結びました。
現在は、我々の持つアプタマーがこれらの病気の治療に役立つかどうかを彼らの手元で逐次的に調べており、非常に良いデータが出ることを期待しているところです。
滲出型加齢黄斑変性(wet AMD)
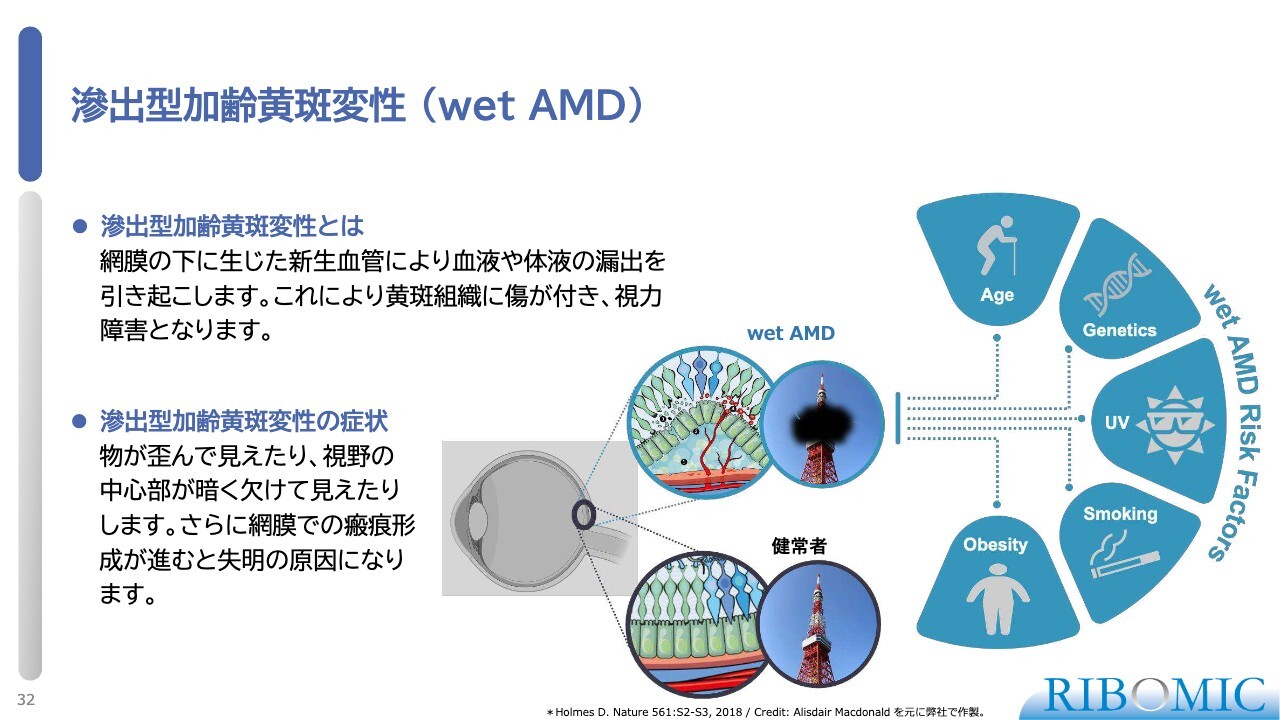
wet AMDを対象とした臨床試験についてご説明します。加齢黄斑変性症は主な原因の1つが加齢で、欧米のシニアの1パーセントがこの病気にかかり、放っておくと失明します。
目の奥底でいろいろな刺激によって炎症が起き、血管新生という現象が生じます。新しくできた血管はもろいため、そこから血液がリークして底に溜まり、きれいな層状構造を壊して視力を失います。
すでに原因がわかっていますので、血管新生を抑制するためにVEGFという成長因子を阻害する薬があります。目の硝子体に直接注射する薬が開発され、「Eylea」と「Lucentis」という薬によって約2兆円の大きな医薬品市場が作られています。
標準治療(抗VEGF薬)の Unmet Need

VEGF治療薬は標準治療となっているものの非常に大きな問題があり、3分の1から4分の1の患者さまには効きません。
加えて、スライドに示しているように、標準治療を受けて治療をしている人でも1年目、2年目、3年目になると線維化のリスクがあります。目の一番奥で「スカー」と呼ばれるかさぶたができ、線維化が進み続けると、最終的に失明します。それを止めることができないというのが、非常に大きくアンメットな問題です。
我々の「RBM-007」は、血管新生だけでなく線維化も抑制する特徴があります。そのため、新しい薬を投入できるのではないかと思って臨床試験を米国で実施したことは、これまで何回もご説明してきたとおりです。
米国における wet AMD に対する臨床試験
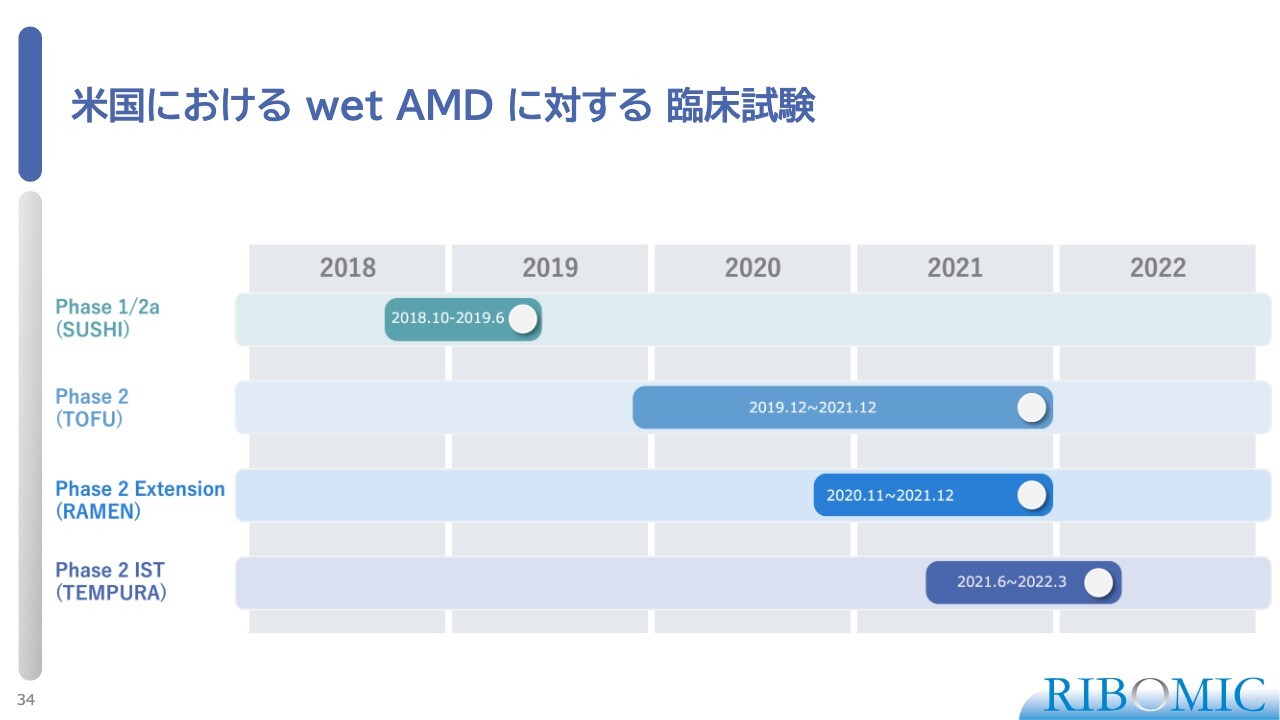
こちらのスライドは、米国での臨床試験の概要と期間を示したものです。
RBM-007 の臨床 POC(Proof of Concept)確立
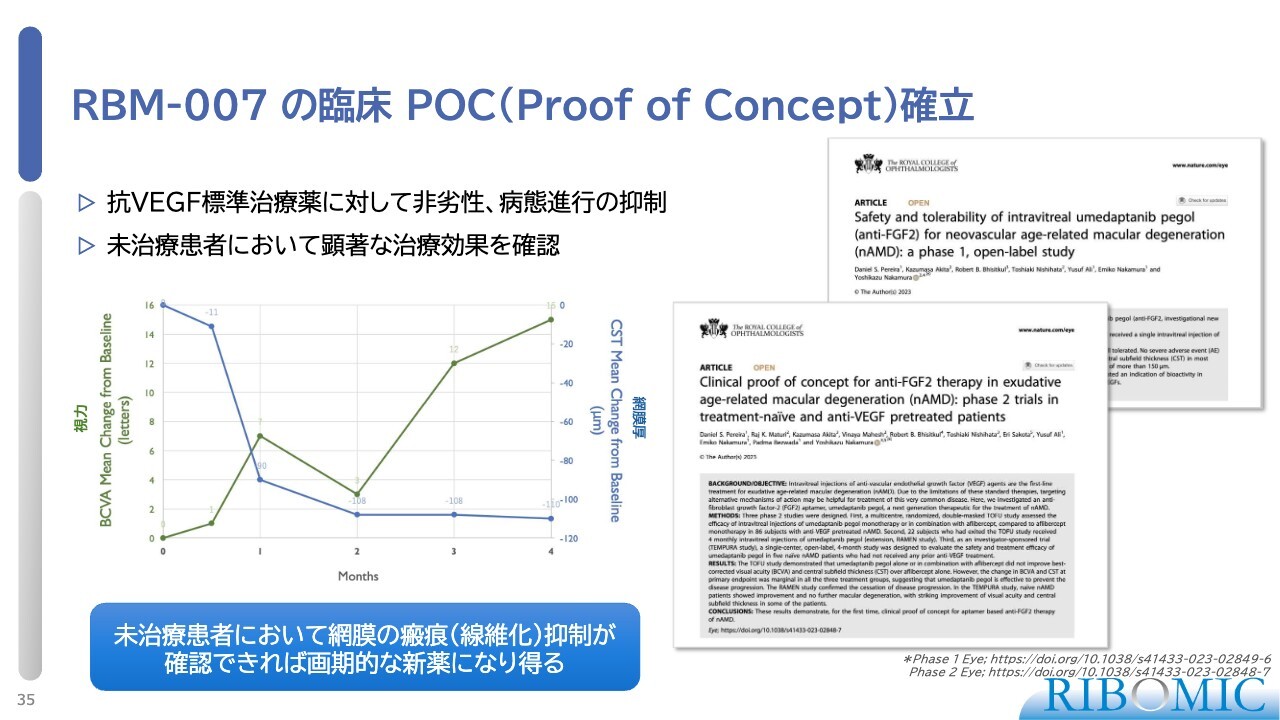
結論として、我々の薬は、この病気に対して期待どおりの有効性を示すことが明らかになりました。まず、標準治療薬に対しては非劣性であり、同じぐらいの効果です。加えて、病態の進行を抑制することがわかりました。特に、未治療の患者さまにおいて劇的な効果がよく見られます。
スライド左側のグラフで一例を示しています。緑の線が視力の回復を表しており、1ヶ月おきに3回眼球注射することで視力が非常に大きく伸びています。青い線は炎症部位の厚みを示していますが、劇的に下がって正常になっています。これらは2つの論文として、今年初めに発表しました。
我々は未治療の患者さまにおいて、よりシステマティックに網膜の瘢痕および線維化抑制の効果を適切に証明できれば、非常に新しい薬になり、ほかの既存薬にも負けないようなマーケットが作れると考えています。
今後の計画:提携実現と承認申請のための臨床試験の実施
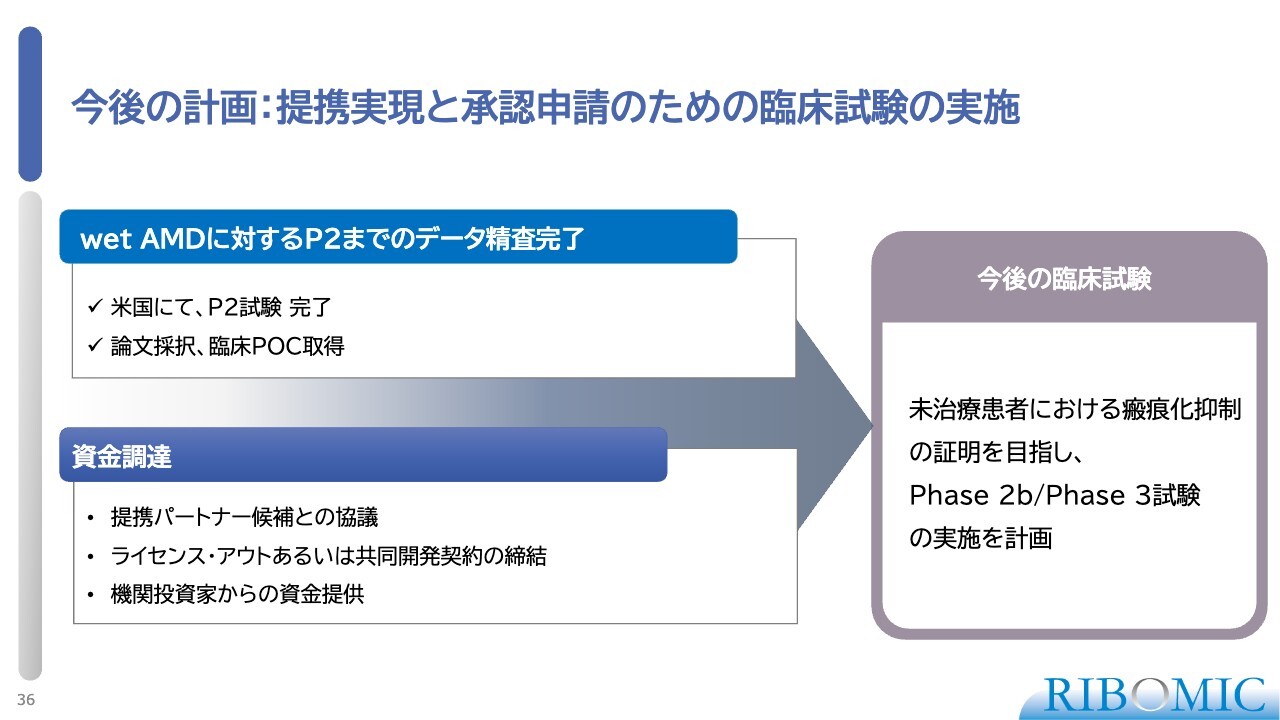
我々としては、ぜひwet AMDの未治療の患者さまで薬の臨床効果をしっかりと調べたいと思っており、そのためには何としてもパートナーが必要です。また、ライセンス・アウトあるいは共同開発を行うためには、資金の提供が必要です。我々はそのようなかたちでずっと努力して、なんとか資金の目処をつけたいと思っています。
このように、網膜疾患のwet AMDに関しては、本当に画期的な薬を作り出せるチャンスがまだ残っていると考えています。
世界におけるwet AMD患者数とVEGF阻害剤の市場
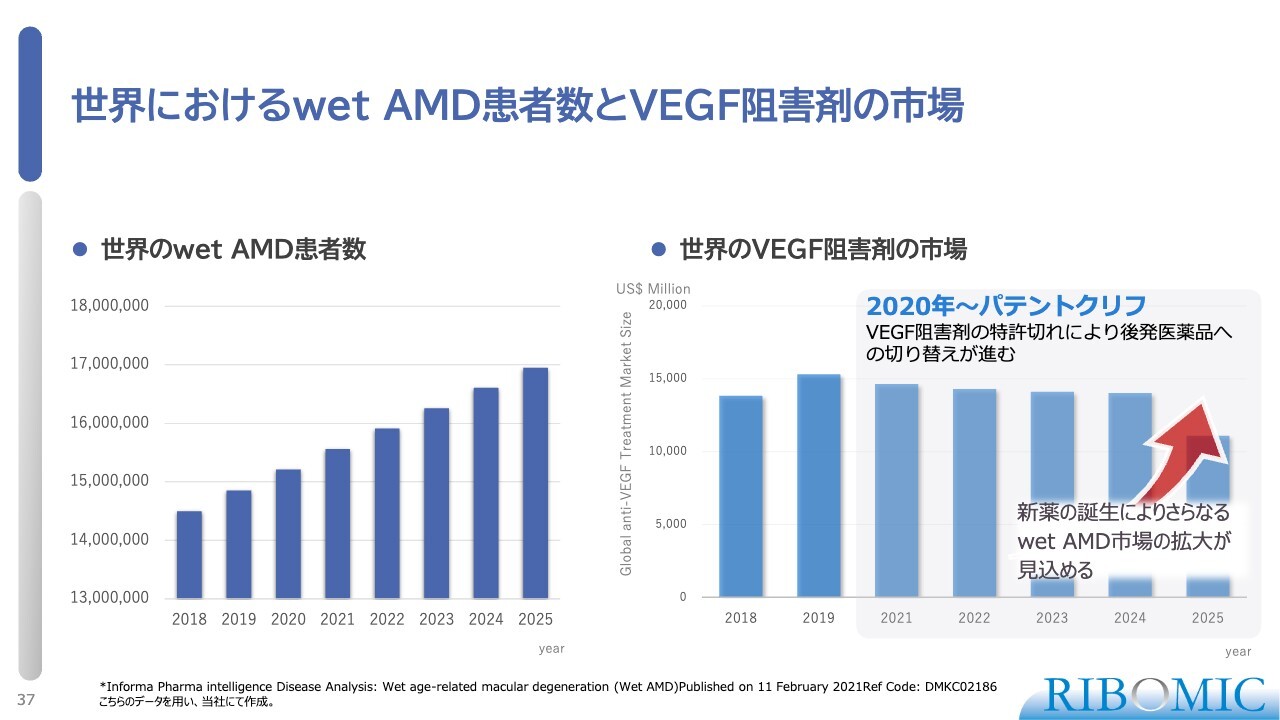
スライド左側のグラフはwet AMDの患者数を、右側のグラフは世界のVEGF阻害剤のマーケットを示しています。VEGF阻害剤はすでにパテントが切れているため、パテントクリフがあって新しい薬が出れば、大きくその市場をつかめるということを示しています。
RBM-006(抗Autotaxin アプタマー)
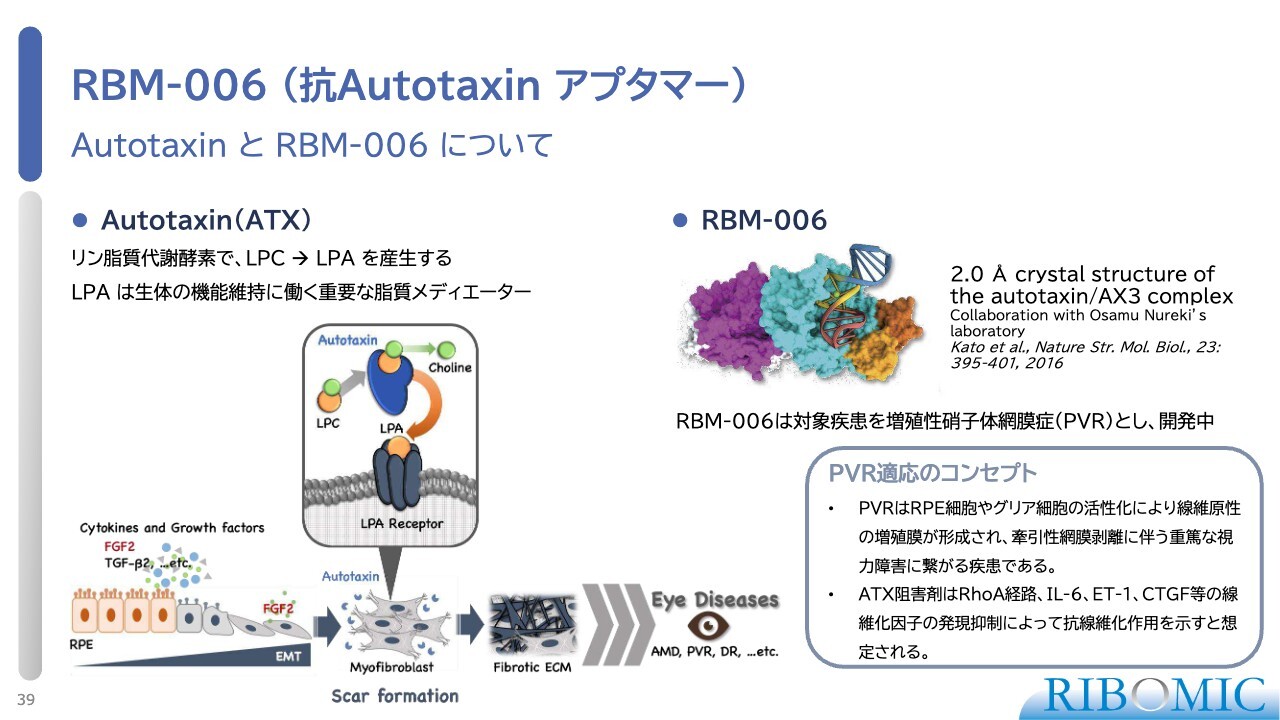
眼科疾患に関して、Autotaxinに対するアプタマー「RBM-006」のご説明をします。Autotaxinはリン脂質代謝酵素で、LPCからLPAを作る酵素です。LPAは脂質メディエーターと言って、我々の体のいろいろな臓器で非常に重要な働きをします。そのLPAの濃度が亢進すると、いろいろな障害を体に起こします。
その1つが線維化で、典型的なものでは肺線維症などがあります。そこで我々は、この病気の治療薬として線維化を抑えるアプタマーをすでに作り、基礎研究でX線の構造解析も済ませています。
作用機序としては、正常なRPEという細胞からEMTという現象を使い、線維芽細胞に線維化を増進します。それが原因で、いろいろな疾患につながっていくことがわかっています。
RBM-006 (抗Autotaxin アプタマー)

我々は、Autotaxinに対する阻害剤アプタマー「RBM-006」を使って、すでにいくつかの非臨床試験をしています。
スライドに記載しているのは、日本大学医学部医学科から旭川医科大学へ移った長岡教授とともに行った、ブタの目を使用した試験です。PVR(増殖性硝子体網膜症)という網膜が剥がれていく病気に対してはまだ薬がないため、長岡教授が持っているブタのモデルで検証したものです。
その結果、「RBM-006」が非常に有効であることが明らかになりました。この効果をさらに確認するため、現在はウサギの目でPVRのモデル型を作って検証を進めており、ぜひ新しい薬の開発につなげていきたいと考えているところです。
次世代型アプタマー医薬品の体内動態抑制に向けた新規技術開発
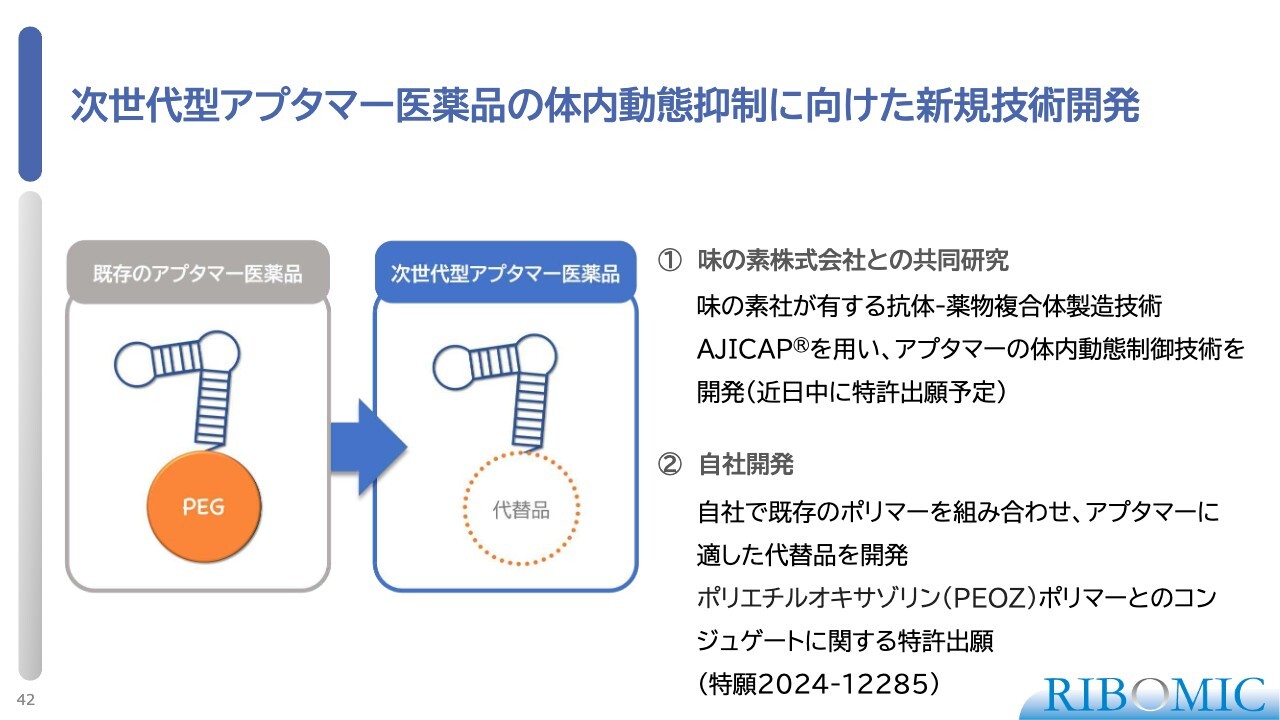
次世代アプタマー医薬品の技術開発についてご説明します。実はアプタマーはそのままだと非常に不安定で、何の細工もせず注射すると、おそらく1分から2分で体から消えていきます。そのため、いろいろな修飾を行って安定性を高めます。
一番の問題は、腎臓から体の外に排出されるスピードが速いことです。それをなんとか止めなければならないため、通常は核酸の末端にポリエチレングリコールという非常にかさが深く大きなポリマーをつけて薬にしています。
しかしながら、ポリエチレングリコールには問題点がないわけではないため、もっとよい代替品がないかを我々はずっと研究してきました。その結果、ポリエチルオキサゾリン(PEOZ)というポリマーが代替でき、同じぐらいの効果があることが明らかになりました。こちらは特許出願を完了しています。
最も強調したいことがもう1つあります。味の素との共同研究を長く続けてきた成果として、味の素が持つ「AJICAP」という技術を用いて、アプタマーをもっと安定化する技術開発ができないか進めてきており、実は成功しました。
まだ詳細なお話はできませんが、近日中に特許を出願する予定にしています。アプタマーでも体内動態を2ヶ月ほど担保できるくらい、強い安定性が確保できるという内容です。
我々のこの技術を使うと、例えば今はACHの患者さまには1週間に1回注射しますが、おそらく2ヶ月に1回の注射で済むぐらいの安定性が確保できると期待しています。ぜひこれを進めていきたいと考えています。
AI アプタマーのコンセプト
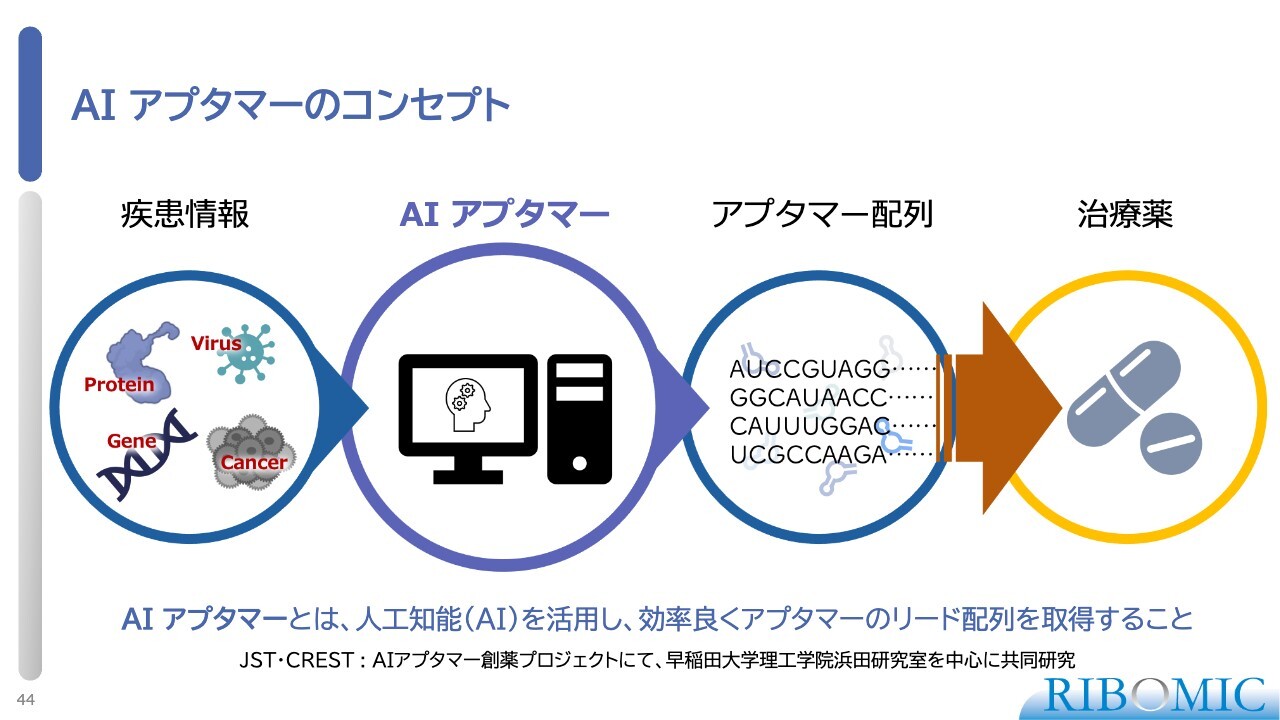
AIアプタマーの開発についてご説明します。人工知能はいろいろなところで使われていますが、これまで繰り返しお話ししてきたとおり、我々もアプタマー創薬に人工知能を使っています。
アプタマーは、「SELEX法」と呼ばれる手作業の方法を用いて魚釣りの要領で釣り上げるため、だいたい1シリーズの試験管操作で100万レベルの配列が出てきます。そのぐらいのレベルの配列をAIを使って分析し、新しい配列を整理・整頓して抽出することが可能です。
実際に、そのような研究を早稲田大学理工学術院の浜田研究室と共同で進めています。
AI アプタマーの進捗
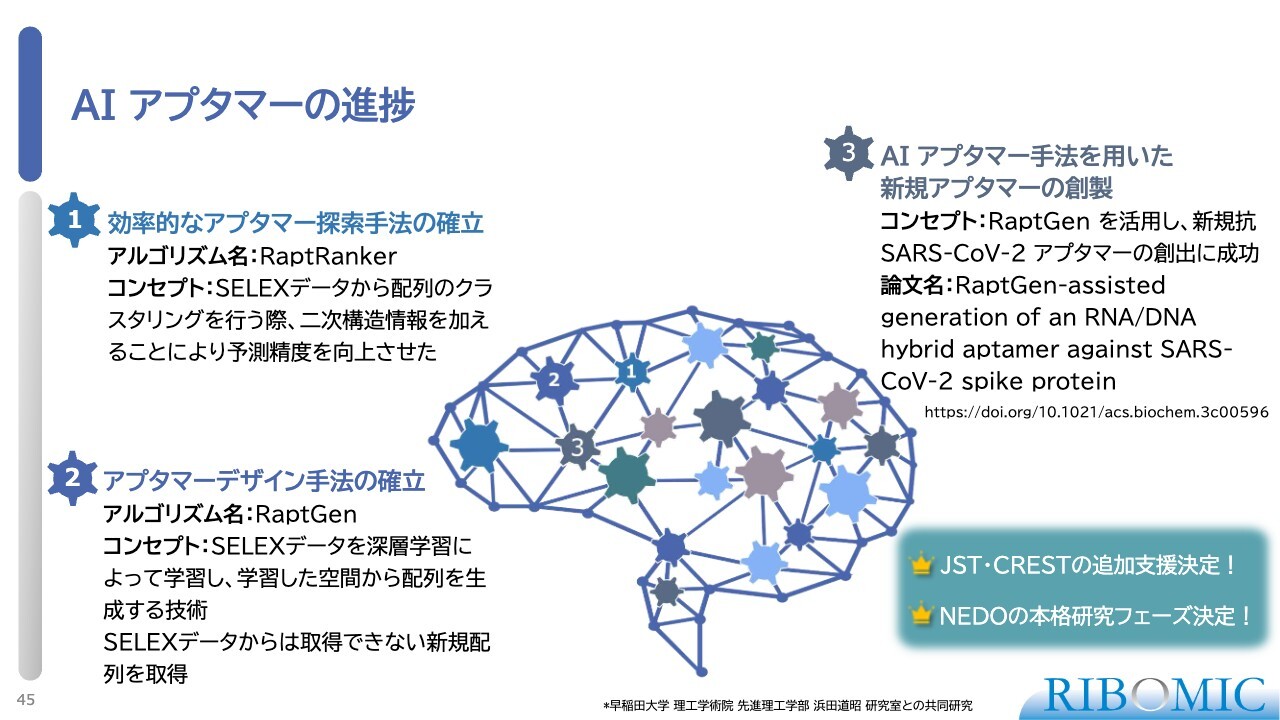
この研究では、実際にいくつかのアルゴリズムを開発できており、コンピュータやAIを使ったシステムから新しいアプタマーを見つけることが現実的になっています。こちらはJSTやNEDOの採択研究として、非常に高い評価を得て進めているところです。
革新的DDSアプタマー技術開発の展望
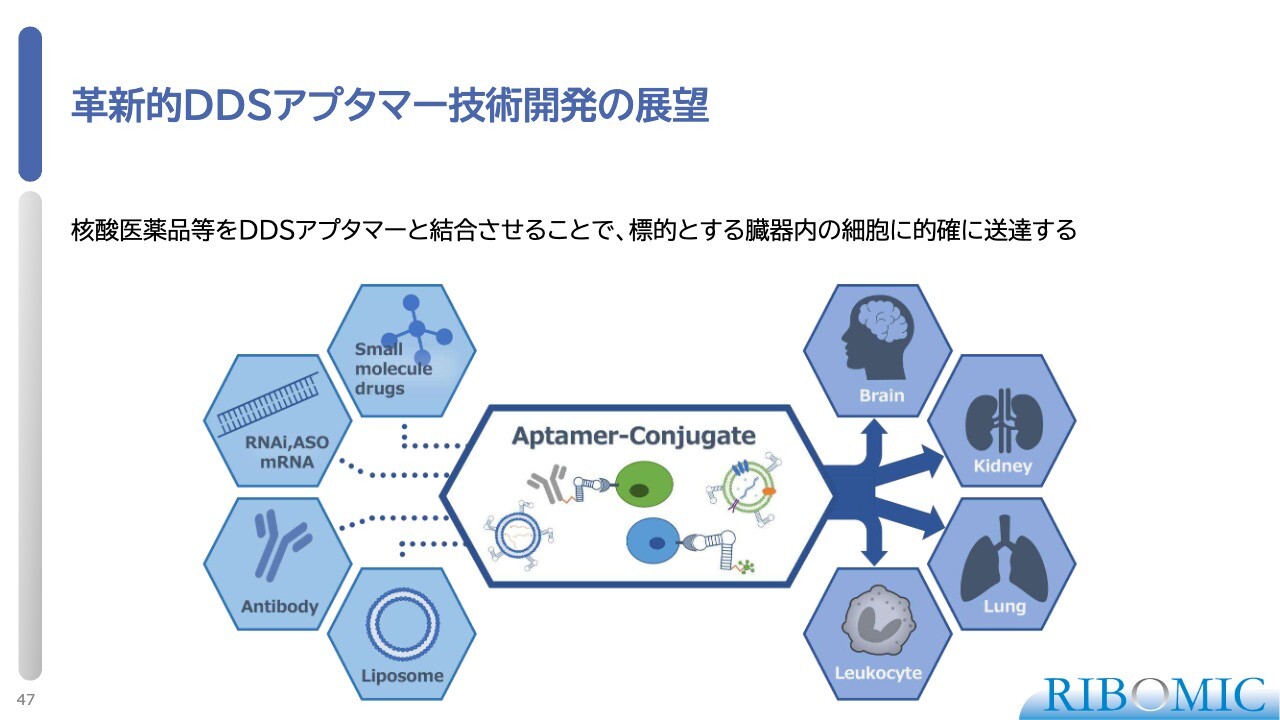
DDS(薬物送達システム)アプタマーについての展望です。核酸医薬品は放っておくと肝臓に集積するため、その他の脳や腎臓、肺、白血球などの細胞を狙い撃ちして運べないという泣き所があります。
そこで我々は、これらの器官に特徴的な細胞外のマーカーを強く認識するアプタマーを作り、それを薬につないで送達することにずっと取り組んでいます。
DDSアプタマーのコンセプト
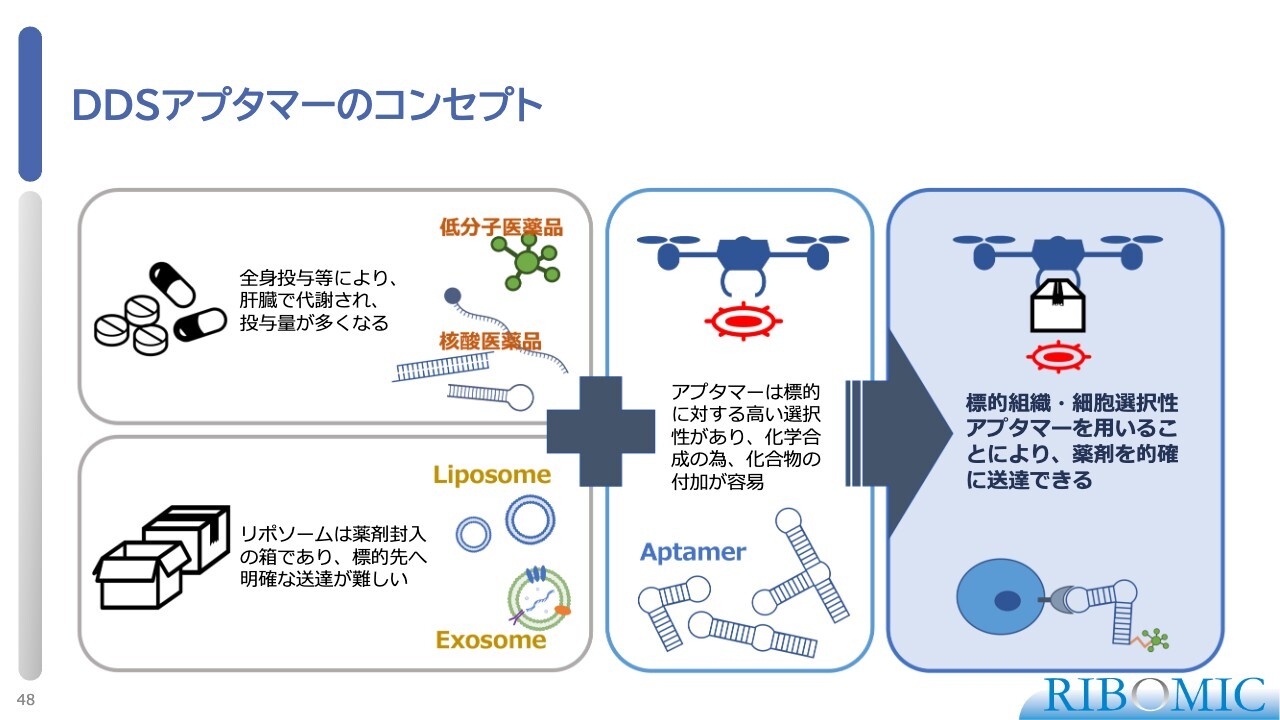
この技術は、ドローンが調達先の目印をキャッチして運ぶようなものとお考えいただければと思います。現在我々は、この技術の開発を非常に精力的に進めています。
新規DDSアプタマー技術開発の進捗
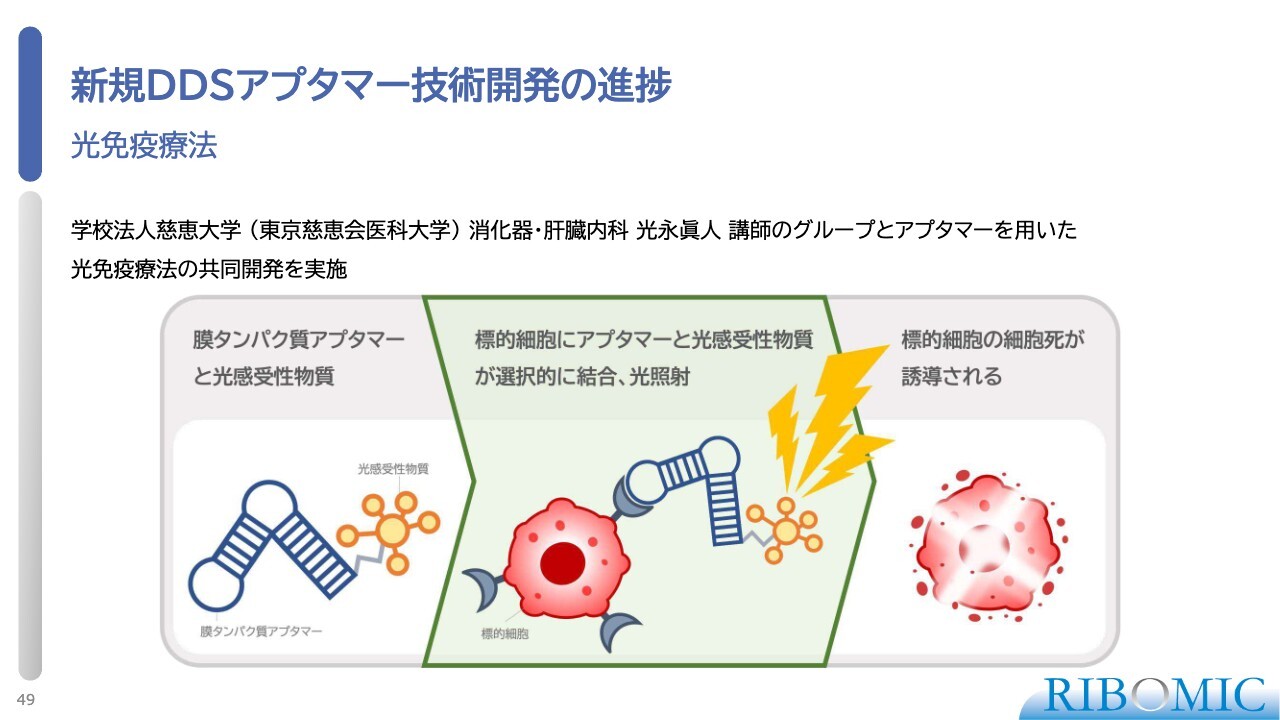
その中でも、東京慈恵会医科大学の光永先生との光免疫療法の共同研究では、アプタマーに光感受性物質をつけてがん細胞に届け、がん細胞のところで光でアクティベートし、その細胞の壊死を誘導するという仕組みを開発しています。
光感受性物質だけではなく、放射性物質をつけても同じようなことができるため、そちらでの方向性も検討しています。
サステナビリティの取り組み
社会に対する企業価値の創出についてです。毎年お話ししていますが、我々は小さい会社ながらも、ESGについてスライドに記載していることを大切にしつつ、社会に貢献していきたいと考えています。
ご説明は以上です。ご清聴ありがとうございました。
この銘柄の最新ニュース
リボミックのニュース一覧マーケットニュース
おすすめ条件でスクリーニング
リボミックの取引履歴を振り返りませんか?
リボミックの株を取引したことがありますか?みんかぶアセットプランナーに取引口座を連携すると売買履歴をチャート上にプロットし、自分の取引を視覚的に確認することができます。
アセットプランナーの取引履歴機能とは
※アセプラを初めてご利用の場合は会員登録からお手続き下さい。










