【QAあり】H.U.グループHD、CDMO事業を担う富士レビオ十勝帯広工場にて見学会を開催、量産に向けた体制構築も完了
十勝帯広工場の紹介
安井宏明氏(以下、安井):十勝帯広工場長の安井から、十勝帯広工場の概要をご説明します。
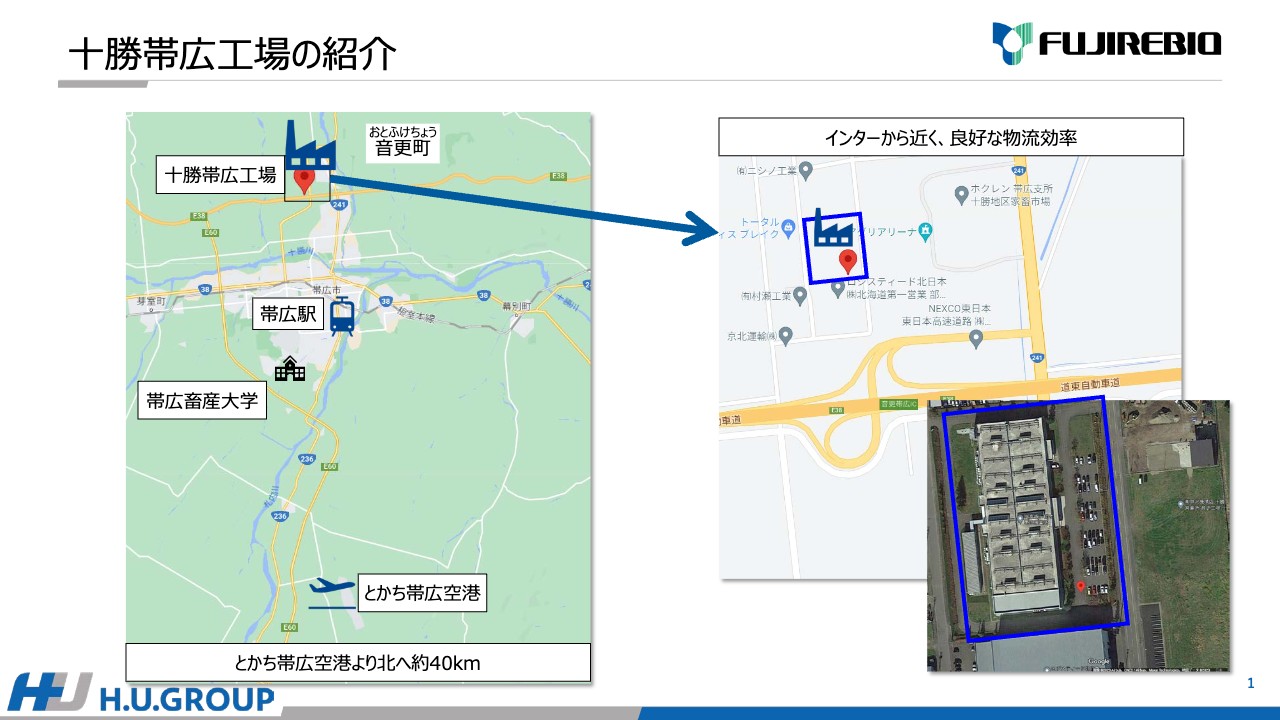
まず、十勝帯広工場の紹介です。本日、みなさまは飛行機でとかち帯広空港に到着されたと思いますが、そこから北に約40キロメートルの場所に十勝帯広工場があります。約12年前にこちらに移転しており、それまでの間は帯広畜産大学の隣に位置しており、技術指導等でお世話になっていました。
とかち帯広空港を降りた後はバスに乗車されたと思いますが、帯広市を中心に十勝川が流れており、そこを渡ると高速道路があります。こちらは、新千歳と札幌方面を結んでおり、東のほうに行くと釧路方面に続いています。十勝帯広工場は、高速道路のそばの音更IC工業団地の一角にあります。
十勝帯広工場の紹介

十勝帯広工場の歴史です。約50年前の1973年に「帯広研究所」として設立されました。先ほどお話ししたとおり、以前は帯広畜産大学の隣の土地に、スライド上段の写真のような建屋が建っており、そこでスタートしたという歴史があります。
本来、動物からの抗体精製などの技術を研究していたこともあり、帯広畜産大学から技術指導等を受けていました。2011年5月に、今後の拡大も見越して、音更IC工業団地に移転しています。
2017年4月には「ルミパルス」用の仕掛原料製造が八王子工場から移転し、今回ご覧いただく結合粒子、標識体の製造が十勝帯広工場に移転されました。
今後のCDMO事業の拡大等も見据えて、2年前の2021年3月には、みなさまが今お訪ねいただいているプレハブ棟の新築を行いました。こちらは今後の人材の増加に対応して建てられています。
また、培養エリアの拡大や「ルミパルス」結合粒子、標識体の増産など、いわゆるCDMO事業に向けた対応で、2021年9月に改修・増築工事を完了しています。2022年10月には、CDMOとして初出荷が叶いました。
今後のCDMO拡大に向けた展開の1つとして、2022年12月には体外診断用医薬品製造業の登録を行いました。今年6月には「EU TRACE」に登録しました。こちらは、動物由来成分を含む製品をEU域内へ輸出する場合に必要になります。
改修・増築するまでの間、本来十勝帯広工場は原料の製造で細胞培養なども行っていましたが、それと同時に動物の免疫業務も行っていました。例えば、ヤギやウサギ等を飼育し、そこに免疫ということで、抗血清という血清を採るような作業も以前は行っていました。
現在ヤギに関する業務はなくなったものの、ウサギに関して必要なものは外部のメーカーに委託しています。工場内での業務としてはすべてなくなったため、この場所は細胞培養ができる場所として改修を行いました。こちらも本日ご覧になっていただきます。
二宮忠司氏(以下、二宮):少々補足します。こちらに見学にいらっしゃる方から、「なぜここに工場を持ったのですか?」と必ず聞かれます。50年前は本日ご覧いただく細胞培養を使った抗体製造の技術がまだ立ち上がったばかりで、基本的にはヤギやウシ、ウサギ、マウスなどの動物の免疫で原料を作ることが主流でした。
もちろんウサギやマウスのような小型の動物は、例えば我々の八王子工場でも飼育できますが、都市部でそのようなことを行うと近隣住民から臭い等に関する苦情がかなり多くあります。
また、ヤギやウシ等の大型動物の飼育はノウハウも必要です。当時は帯広畜産大学のすぐ隣の敷地が空いていたため、そこに小さな研究グループを立ち上げたというのが、我々が帯広に拠点を持った最初の理由です。
その後、性能の問題もありますが、世界的な環境配慮の観点も含めて「できるだけ動物は使わないように」という潮流になっているため、我々も徐々にそちらに移っていきました。
本日ご覧いただく一部のエリアでは、つい3年前までヤギ等を飼っていましたが、自前で製造するほどの量は使わなくなったため、今は基本的に動物飼育はすべて外注しています。これを機に工場を改装・増築し、細胞培養を拡大して、将来のCDMOに備えています。
我々が帯広に拠点を持った理由と帯広工場の今後の活用については、今お話しした背景があってのこととなります。
十勝帯広工場の位置づけ(サプライチェーン)
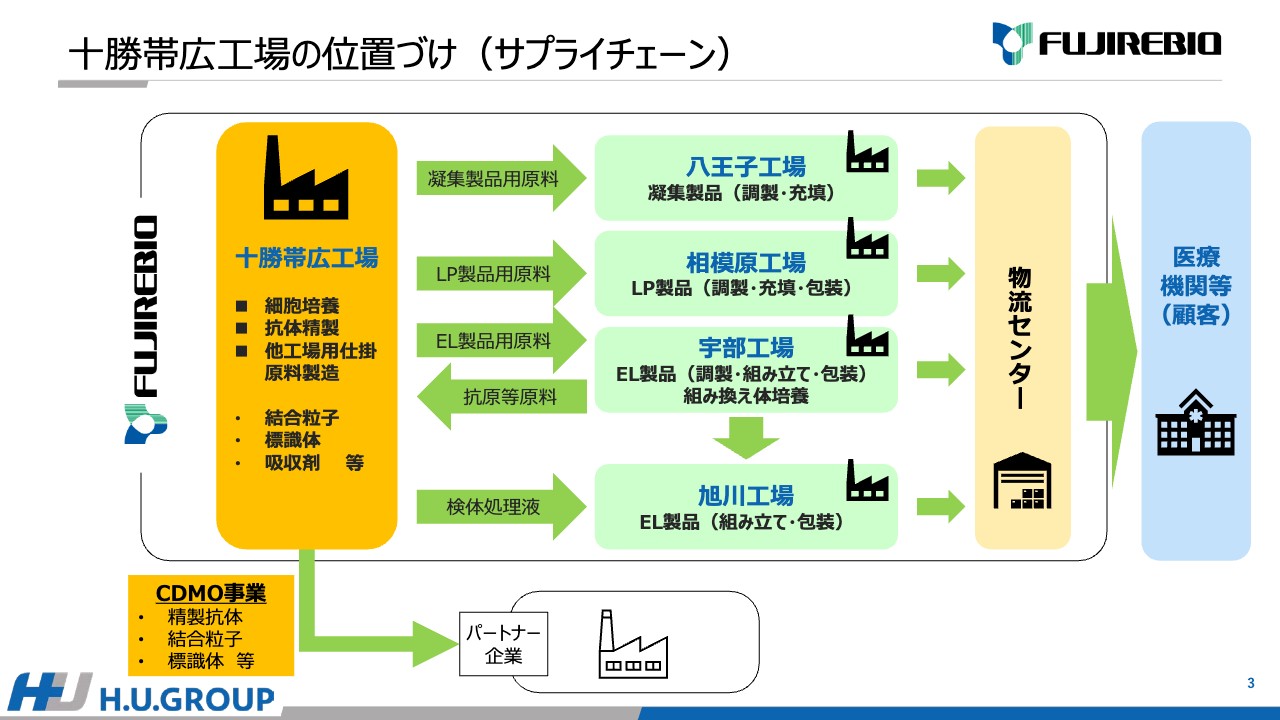
安井:十勝帯広工場の位置づけについてご説明します。先ほどお伝えしましたが、十勝帯広工場は、細胞培養や抗体の精製、仕掛原料となる結合粒子、標識体、吸収剤などの原料の製造を行っています。
富士レビオには、八王子工場、相模原工場、宇部工場、旭川工場があります。八王子工場の場合は、凝集製品の製造を行っています。そこに向けた原料を十勝帯広工場で作っています。
相模原工場では「ルミパルス」の製品製造・充填・包装を行っています。そこで使用される結合粒子や標識体を十勝帯広工場で作っています。
宇部工場と旭川工場では、「エスプライン」と呼ばれている簡易キットを作っています。新型コロナウイルスの検査の簡易キットのような製品で、その標識体、あるいは吸収剤を十勝帯広工場で作っています。
宇部工場に関しては「エスプライン」だけではなく、組み換え体の培養や大元となる粒子なども作っています。十勝帯広工場の原料として持ってきて、こちらで加工し、「ルミパルス」製品にするという流れとなっています。
八王子工場、相模原工場、宇部工場、旭川工場で製品を作り、包装までできたものに関しては物流センターに送られて、各ユーザー等に届けられる流れとなっています。
2022年10月までは十勝帯広工場で作られていた原料はすべて自社内で使用していましたが、2022年10月以降はCDMO事業として、精製抗体や結合粒子、標識体をパートナー企業に販売することが実現しました。
こちらの拡大と将来に向けた対応ということで、事業として拡大し、工場で製造を行っている状況です。
二宮:1点補足します。工場の基本的な役割はスライドに記載のとおりですが、実は物の流れがこれまでの既存事業とCDMO事業とでは大きく異なっています。
例えば、既存の「ルミパルス」や凝集の製品は、基本的には「make to stock」で、予測に基づいて在庫をためておき、そこからお客さまに提供します。ですので、基本的には物流センターにすべての製品をいったん集約し、出荷します。
一方、CDMO事業は、基本的には「make to order」で、いわゆる受注生産です。製造の時期・量は、お客さまのオーダーに従います。それこそ、お客さまによって扱う品目・量・タイミングがまったく異なるため、そのようなものを物流センターにいったん集約させるのは、オペレーション上、非常に効率が悪くなります。
ですので、CDMO製品に関しては、物流センターは介さずに、原料を製造している工場から直接お客さまに出荷します。その点のサプライチェーンは大きく異なっています。
先ほど「EU TRACE」についてお話ししましたが、例えばアルブミンなど動物由来の原料を含む製品をヨーロッパに出荷するためには、「EU TRACE」に登録しておかないと出荷できません。
CDMOは各工場が直接お客さまに出荷しますので、その出荷についての登録・認証もCDMO製品の出荷を担当する工場ごとに用意する必要があります。
昨年にそれがすべて終わりましたので、十勝帯広工場は量産してお客さまにモノをお届けする体制も整っています。
ルミパルス試薬/エスプライン製造プロセスとCDMO事業の関係
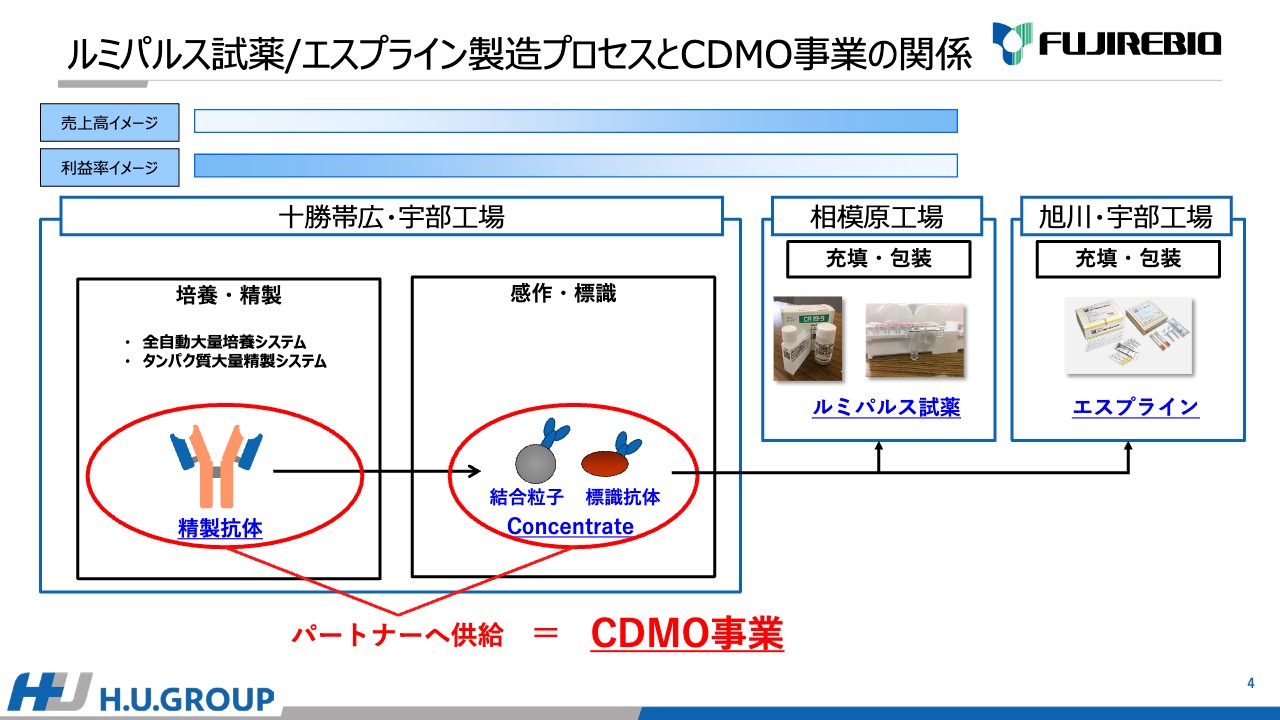
安井:「ルミパルス」試薬/「エスプライン」製造プロセスとCDMO事業の関係についてご説明します。十勝帯広工場と宇部工場の一部では、細胞培養と抗体の精製などの作業を行っています。
培養に関しては、全自動のバイオリアクター(大量培養システム)を導入しています。また、抗体を精製するために必要な機械として、タンパク質大量精製システムを導入しています。それに加え、結合粒子と標識体の製造を行っています。
本日は、細胞培養、抗体精製、結合粒子、標識体の作業内容を、実際に現場でご覧いただく予定です。
精製抗体、結合粒子、標識体をCDMO事業としてパートナーへ供給する流れに加え、本来自社内で使用するための結合粒子、標識体を作り、「ルミパルス」の原料として使用したり、「エスプライン」の原料として使用するという流れとなっています。
原料製造は最上流の工程になります。下流工程にいけばいくほど充填・包装などで手がかかり、負荷がかかってきますので、利益率は下がっていきますが、上流であればあるほど利益率が高くなると言えると思います。
逆に、売上高に関しては、完成品のほうが高くなる傾向です。
【参考】抗体の性質
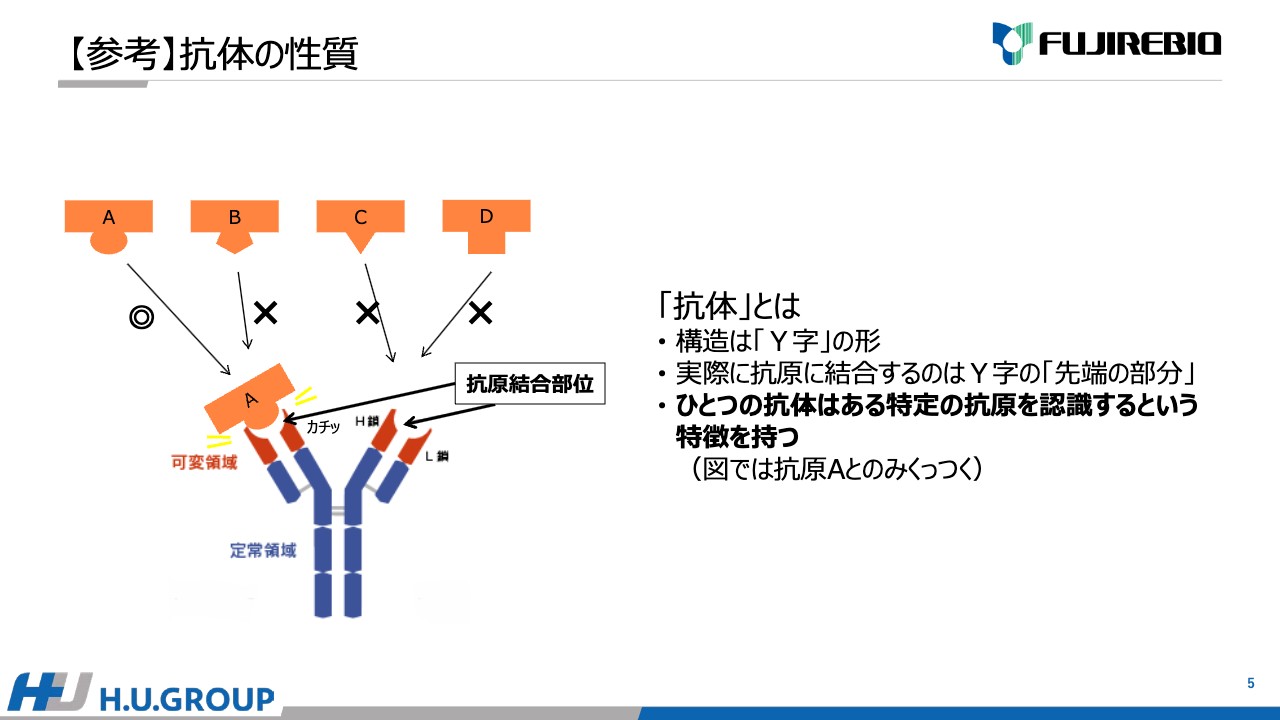
抗体の性質についてご説明します。スライドの図のとおり、「Y字」のような構造です。「Y字」の先端の赤色部分が可変領域で、抗原を認識して物理的にくっつく特徴を持っています。
さまざまな抗原がありますが、スライドの図で言いますと、「抗原A」という特定の抗原のみを認識してくっつきます。十勝帯広工場ではこのような抗体を作成しています。
【参考】人体「内」で抗体が作られる機序

人体の中で抗体が作られる機序についてご説明します。細菌やウイルスなどの異物が体の中に入ると、侵入してきた異物をマクロファージが取り込みます。取り込んだ異物をマクロファージがヘルパーT細胞へ提示し、ヘルパーT細胞が抗体準備の依頼をします。
抗体を作る流れとして、ヘルパーT細胞から抗体を作る指令が出されて、B細胞が抗体を作ります。ごく簡単にご説明すると、このような作用機序で抗体が作られているのが一般的な考え方です。
【参考】人体「外」で抗体を作るには

B細胞は無限に抗体を作れるわけではなく、寿命がありますが、ミエローマ(骨髄腫)と融合させることで無限に抗体を作らせることができます。ここでは、人体外で抗体を作る方法についてご説明します。
まず、抗原免疫したマウスから、B細胞を採取します。しかし、B細胞は寿命があるため、無限増殖が可能なミエローマ細胞を用意します。この2つの細胞を融合させることで、無限に増えていく抗体を作るハイブリドーマ(融合細胞)を作ることができます。
欲しいモノクローナル抗体のハイブリドーマをスクリーニングし、選別を行います。そして、選別したハイブリドーマを増やし、凍結保存して製品化します。
さまざまな抗体を作る会社は多くありますが、富士レビオは、動物は使用せず、細胞そのものを用いて増やして抗体を作るという作業を行っています。
無限に増殖するハイブリドーマ細胞を用いることによって、効率よく抗体を製造することができています。
二宮:免疫はかなり奥が深いため、わかりやすく説明するのは非常に難しいのですが、ポイントとしてご理解いただきたいのは、人やマウスなど動物が持っている生体防御機能の中で作られる抗体を、特定のウイルス等を引っ掛けるための鈎や釣り針のように利用するのが、我々の技術の基本です。
この後の見学の時にもハイブリドーマという言葉がいくつか出てきますが、ミエローマ細胞は要するにがん細胞です。がん細胞と正常細胞の何が違うかと言いますと、がん細胞は、無限に増殖を繰り返すという点です。
一方で、抗体を作る細胞はB細胞だけですので、理屈としてはB細胞だけあれば抗体は作れます。しかし、B細胞は増殖させることが難しいため、B細胞だけを用いた生産は現実的ではありません。
そこで、がん細胞とマウスのB細胞を融合させたハイブリドーマという状態にすると、無限に増殖するがん細胞の特徴と抗体を作るB細胞の特徴の両方を兼ね備えた細胞に化けてくれます。
ハイブリドーマの状態にして取り出すと、マウスなどの動物を都度使わなくても、培養装置の中で無限に培養することができます。モノクローナル抗体については原則、この原理に基づいて製造されています。これは富士レビオだけの特徴ではなく、一般的なモノクローナル抗体の製造方法になります。

富士レビオの優れている点についてご説明します。スライドの図では「抗原A」にしか結合しないということで、非常にシンプルでわかりやすくなっています。
しかし、体の中に入ってくる異物は非常に多くの種類があり、図のように「抗原A」「抗原B」「抗原C」「抗原D」と明確に違いがあるわけではなく、とても微小な違いです。
その微小な違いをきちんと認識できるか否かで抗体の性能は決まります。きちんと認識できる性能の良い抗体をどのようにセレクションして樹立するかは、製造メーカーのノウハウです。教科書や論文に載っているわけではありません。
例えば、「がん細胞だったら、このように選択すればおそらく良い抗体が作れるだろう」ということが、富士レビオは50年近い診断薬の研究の中でノウハウとして蓄積しています。他社も努力しているとは思いますが、富士レビオが特定のタンパクなどに対して非常に性能の良い抗体を作ることができるのは、そのような理由があるからです。
ですので、富士レビオの特色は、性能の良い抗体をセレクションし、選別できることです。それに加え、先ほどのバイオリアクターで大量に効率よく増やす技術を持っていることは、他社に比べると有利な点かと思います。
製造工程(概念)

安井:製造工程の概念についてご説明します。まず本日ご覧いただくバイオリアクターなどを使った、いわゆる細胞培養を行い、「Y字」の抗体をどんどん作らせます。次に、この増やしたものの中には不純物も含まれていますので、「Y字」の抗体だけを取り出して濃縮する作業を行います。
最後に、磁性粒子や酵素をくっつける作業を行い、抗体結合粒子や酵素標識抗体と呼ばれる抗体へ加工することで、自動分析器で使用できるかたちへもっていきます。
二宮:ちなみに、バイオリアクターが設置されているエリアはもともと動物飼育室でした。3年前までこちらにヤギやウサギがおり、実際に動物を用いた抗体精製を行っていました。
従来の製造エリアはこれまで使っていた自社製品用だけの製造スケールを担っていたため、それほど生産量が多くはありませんでした。
それに対し、動物舎を改造したエリアは、大規模生産用に新しく整備したエリアであり、細胞を大量に培養するバイオリアクターや大型の製造装置が設置されています。
また、過去は更地であったエリアについても、今回の動物舎の改修にあわせて建物を建て増しし、大規模製造用のエリアを一部用意しています。
バイオリアクターという培養装置は、後ほど製造現場でもご覧いただきますが、富士レビオではまだ100パーセント設置しきれてはいません。十勝帯広工場で16台、宇部工場で8台、合計24台を最大で設置する予定です。
ちなみに、アメリカの関連会社のFDIも同じ技術で細胞培養しており、25台持っています。我々グループ全体で約50台のバイオリアクターを持っていますが、いわゆる診断薬の業界でバイオリアクターをここまで持っている会社は、おそらくないと思います。
食品系や医薬品の会社では比較的よく使われていますが、診断薬メーカーでここまで大量製造に備え、この装置を多く持っている会社はおそらくありません。特に国内の診断薬メーカーでは、富士レビオがバイオリアクターを最初に導入した会社だと思います。
ただし、実は導入に非常に苦労しました。アメリカの会社の機器ですので、日本によるサポート法人がほぼなく、設置の時にトラブルが起こると、場合によってはアメリカからサービス担当者に来てもらったり、アメリカの会社と定期的に電話でやり取りしなければならないという難しさもあります。
これまでの細胞培養の技術では、大量の需要が想定されるCDMOの製造・増産には耐えられません。バイオリアクターは従来の培養技術に比べると生産性が著しく高いため、グループ全体でこれを大量導入し、増産に備えています。
製造工程
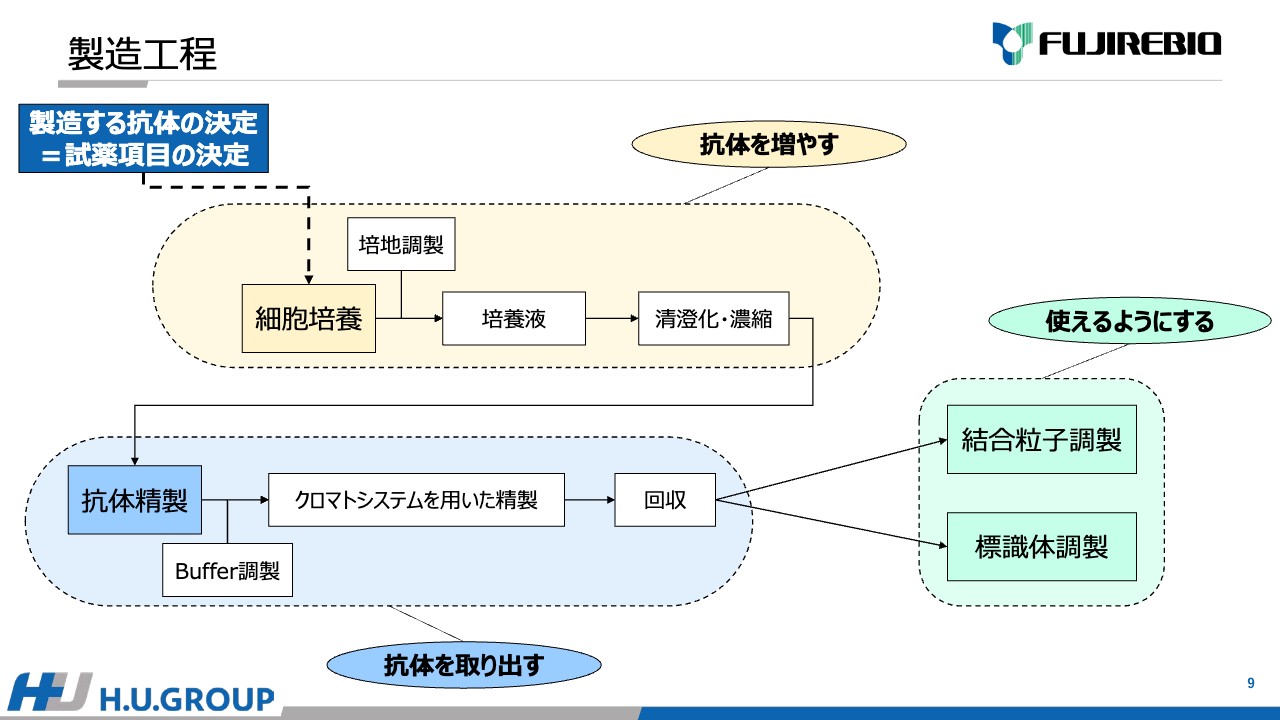
安井:製造工程の流れについてもう少しご説明します。まず最初は細胞培養ですが、細胞培養を行うためには栄養分である培地が必要ですので、培地の調製を行います。
細胞を培地で増やし、培養液を取り出します。この製造工程を当社では大容量スケールの場合はバイオリアクターが担っています。これまで用いてきた培養方法は小さいスケールのものであればフラスコ培養、カルチャーバッグ培養などさまざまありますが、出来上がった培養液には必要としないものが混ざっているため清澄化したり、薄い状態のものを濃くする濃縮作業をこの後行います。
そして、出来上がった培養上清の抗体のみを取り出すために精製作業を行います。クロマトシステムと呼ばれるシステムを用いて抗体を精製します。
クロマトシステムを用いた精製では、Bufferという液体を調整した上で、それを用いてクロマトシステムに培養上清を流し込んでいきます。この精製方法には、「ゲルろ過」や「Protein A」を使った精製があります。そのようなものをカラムを用いて、抗体だけを分離し取り出していきます。
出来上がったものを回収し、結合粒子調製や標識体調製を行い、「ルミパルス」などに用いたり、CDMO製品として販売します。抗体そのものも、CDMO製品として販売しています。
二宮:本来この製造工程はCDMO事業に参入する以前から行っているプロセスです。ですので、CDMO事業のために富士レビオは特別新しい工程を追加したわけではなく、これまでの自社製品の製造プロセスの中で出来上がってくる大元の原料、もしくは副産物をCDMOの商材としてそのまま使用することができます。工程や手順などで特別なことを行っているわけではありません。
富士レビオ独自ブランドの自社製品と、CDMO事業が難なく両立できたのは、基本的に現状の工程の中で出来上がる中間材を商材として利用できることが背景にあります。これが我々がCDMOのビジネスに参入しやすかった1つの理由でもあります。
細胞培養工程 詳細

安井:細胞培養工程について、詳しくご説明します。細胞培養では、まず培地の調整を行います。培養方法はフラスコ・カルチャーバッグ・ホローファイバー培養といくつかあります。
培養スケールについては、フラスコなどの小さなものからバイオリアクターといった大きなものまでありますが、目的とする抗体によって最適な培養方法を選択します。
出来上がった培養液は回収し、清澄化、培養上清の保存を経て精製工程に向かいます。工程期間は短期で1ヶ月、長期では6ヶ月と、ホローファイバーに関しては長期間の培養時間が必要となっています。スライドには「2〜6か月」と記載しましたが、バイオリアクターは2ヶ月足らずです。短期間で1クールできますので、バイオリアクターは短期間のうちに抗体を培養することができるシステムとなります。
二宮:抗体の使用量は製品によって使用量のスケールが大きく異なり、年間の生産量では1,000倍以上の開きがあります。そのため、バイオリアクターのような大量生産向きのものは、大量に安く作るという意味で非常に優れた技術ですが、使用量の少ないものを同じような製法で作ってしまうと作りすぎて在庫が山ほど積み上がってしまいます。
フラスコやカルチャーバッグは昔からある方法で、生産効率全体を見るとそれほど高くはないものの、使用量に応じてスケールの違う培養方法を使い分けることで、最適な生産・在庫計画を実現することができています。
そのため、現在はフラスコで作っている程度の少ない量でも、新しくCDMO事業の顧客が獲得でき、生産量が伸びてきた時には、大量生産の方法に移行すればよいということです。
富士レビオは複数の培養方法を製造方法として樹立しているため、今後の事業成長や顧客拡大に合わせて最適な製造方法を選べるという点でも有利だと思っています。
バイオリアクターの原理
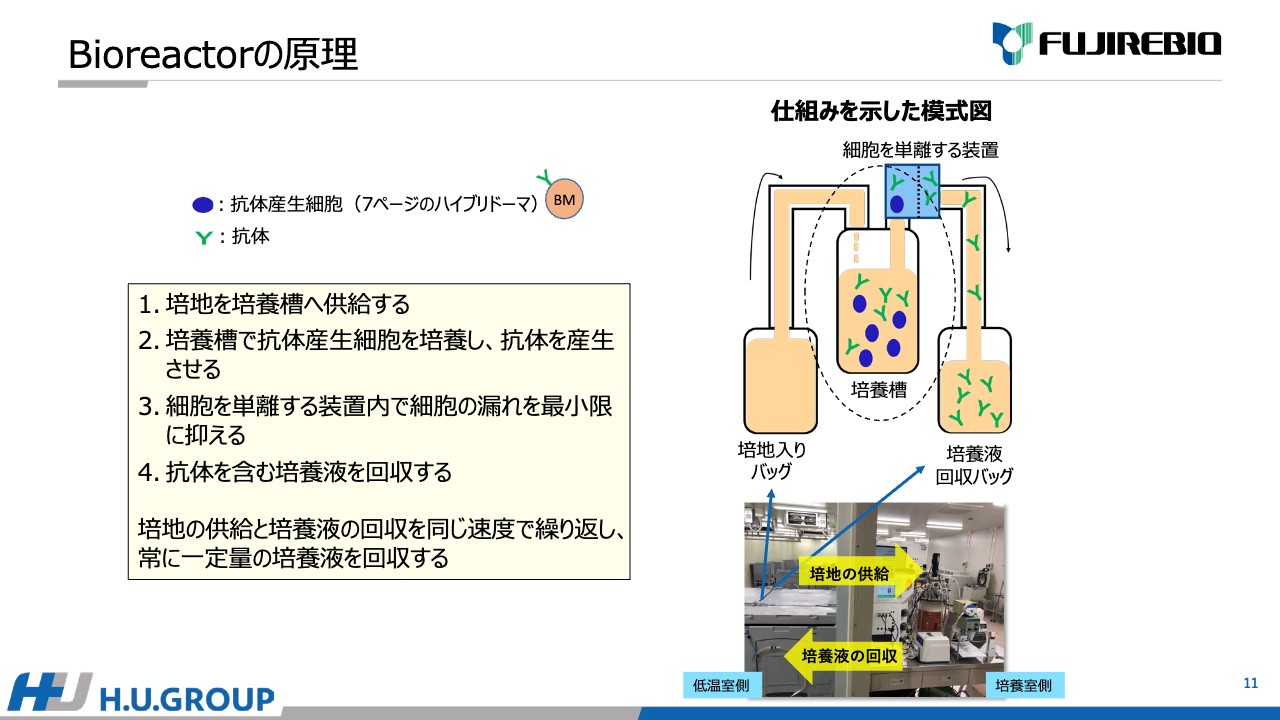
安井:バイオリアクターの原理についてご説明します。こちらの中心部の培養層、写真で言うと茶色い部分に抗体を産生させるための細胞、ハイブリドーマ細胞が入っており、細胞の増殖等を行います。
細胞培養にあたり栄養源となる培地を入れる必要がありますが、低温室の中に培地のバッグが入ったタンクと培養液を回収するためのタンクがあります。ここから新鮮な栄養源を送り込み、同時に培養された必要な抗体のみを取り出して回収用タンクに回収する仕組みです。
また、バイオリアクターには細胞と液体成分を分離する装置が装備されており、必要な抗体を含む液体成分を取り出すことができます。
二宮:細胞培養の経験がないとイメージしにくいと思いますが、基本的に細胞は生き物ですので、生きていくための栄養分が含まれた培地と呼ばれる溶液の中で飼います。細胞も増殖を繰り返すと栄養分が減り逆に細胞が作り出した抗体が液の中に充満するようになります。
そのため、バイオリアクター以外の培養の系では、数日間に1回、1週間に1回程度、定期的に人が培地を交換しなければいけません。つまり、そこに必ず人手がかかってしまいます。
しかし、バイオリアクターは交換と回収を自動で行う装置ですので、立ち上げ時に1回セットしてしまえば、例えば1ヶ月放置しても、栄養分の供給と出来上がったものの回収をすべて全自動で行ってくれるため、理屈上は放置しても問題ありません。生産量が上がるだけではなく、人手も大幅に省力化できます。
わかりづらいとは思いますが、人手のかかる面倒な工程がほぼなくなる装置とご理解いただければと思います。
精製工程 詳細
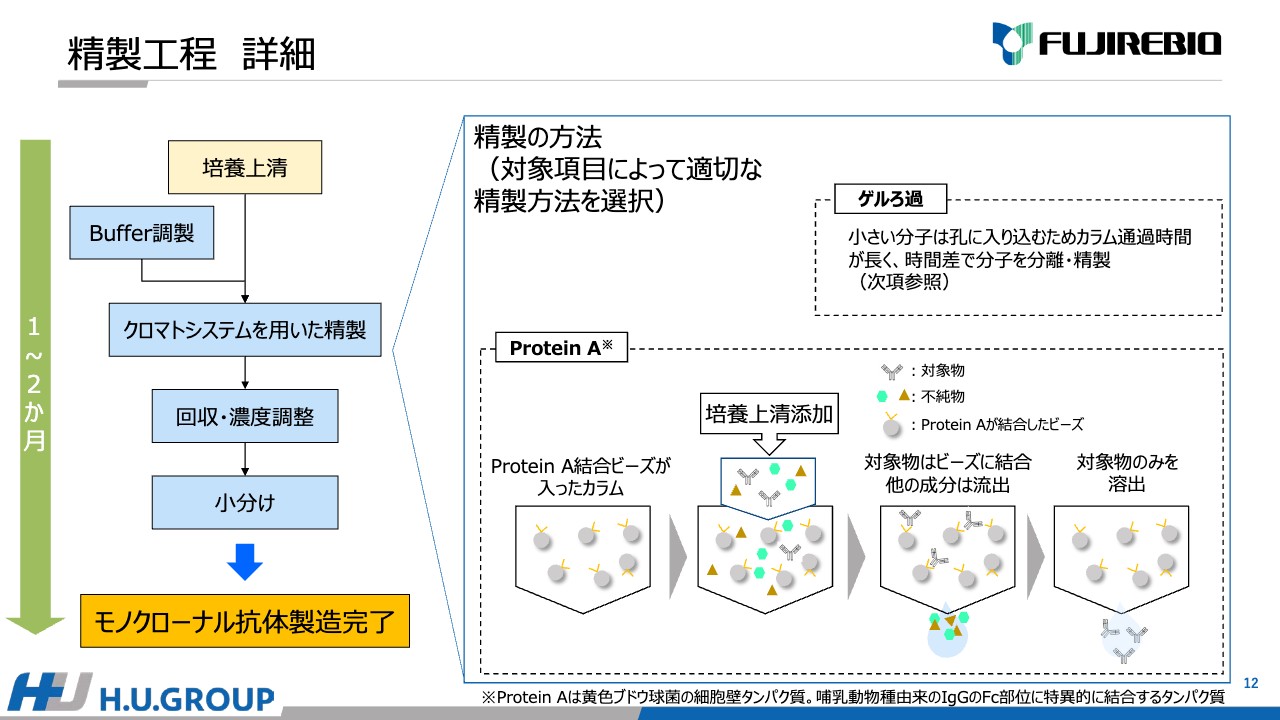
安井:培養液を精製し、抗体を取り出す作業についてご説明します。こちらはモノクローナル抗体の製造工程ですが、細胞培養が終わって出来上がった培養上清をクロマトシステムを用いて精製します。
精製方法には「ゲルろ過」と「Protein A」を使ったものがあります。「ゲルろ過」は分子量で分離できる仕組みで、時間の経過とともに、分子量が大きいものから順次出てくるような原理です。
一方、「Protein A」結合ビーズが入ったカラムを使って精製する工程もあります。対象物をこちらのビーズが入ったカラムに添加すると、取り出したい対象の抗体は「Protein A」に結合しますが、その後、pHや温度の変更によって、一度結合したものの中で必要なものだけを取り出す仕組みです。主にこの2種類の技術を用いて必要な抗体を取り出す作業を行っています。
二宮:培養とは異なり、この精製方法は、富士レビオ独自ではなく一般的な手法で、抗体を製造しているメーカーであれば、ほぼ使っているものです。そのため、我々がここで強みを打ち出すのであれば、生産性やコストの部分です。目的とする製造量などに応じて「どちらのカラムを使ったほうがよいのか?」「一度に製造するスケールをどの程度にすると生産性が高くなるのか?」といったことには我々の努力が必要ですが、技術そのものは非常に一般的なものです。
カラムクロマトグラフィー(ゲルろ過)の原理

安井:「ゲルろ過」の原理について、スライドに図をお示ししています。写真の白い部分が「ゲルろ過」のカラムです。上のほうからサンプル、つまり対象の培養液を流し込むと、時間とともに重たい分子だけが先に分かれて出てきて、軽い分子は時間をかけて出てくる仕組みです。小さい分子は溝に捕まり出てくるのが遅く、大きい分子はあまり邪魔されずにそのまま素通りして出てくるという原理です。
また、スライドに記載している「ゲルろ過」のチャートでは、スタンダードを流した時は重い分子から順番に出てきていることを示しています。時間経過とともに、重い分子が出てきて、軽いものはやや遅いイメージです。
出荷

安井:出荷についてです。抗体がくっついた結合粒子の写真を載せていますが、下にやや茶色く見えているのが磁性粒子に抗体がくっついた状態のものです。また、ALPがくっついた酵素標識体は見た目ではわかりにくい透明の液体です。
出来上がったものについては、結合粒子であれば相模原工場など、各工場に送ります。加えてCDMOとしての出荷も行っています。
質疑応答:海外工場と、国内工場の今後の役割分担について
質問者:以前から海外にもCDMO事業を行っている工場があり、十勝帯広工場は2022年10月からCDMO事業の工場として活動し始め、初めての出荷が始まったとのことですが、今後、海外工場と国内工場との役割分担はどのようになっていくのでしょうか?
例えばパートナー企業が日本であれば日本から出荷して、アメリカ、ヨーロッパの場合はアメリカの工場から出荷してという棲み分けになるのでしょうか?
二宮:原則としてはそのとおりです。直接クライアントのパートナーを持っている事業会社が出荷をします。ただし、その場合でも日本で製造している原料を使うこともありますので、その場合は我々から海外の事業会社に原料を提供して、彼らがお客さまに提供する状態にしたところで出荷するというのが基本的な考え方です。
ただし、例えば一部の抗体原料などは使用量がかなり多くなっていくと、将来1工場では作りきれないレベルになってくると思っています。その場合、パートナーのフロントに立つのは契約をした事業会社ということは変わらないのですが、製造そのものは今後の製造量に応じてヨーロッパに参加してもらう、あるいは日本だけではなくアメリカでも同じ品目を作るなど、製造シェアは今後もあると思います。商流の基本としてはパートナーと契約した事業会社が出荷を担当します。
質疑応答:今日の見学工程の海外工場との同一性について
質問者:基本的に本日見学させていただく工程は、FDIの海外の工場と同じ機能を持っているという理解でよいですか? それともこちらだけ特別の工程がありますか?
二宮:工程そのものは共通です。ただし、バイオリアクターのような大量製造装置を持っているのは今のところ当社とアメリカのFDIです。現在、試験的にヨーロッパなどの会社でも立ち上げようとはしていますが、実際にその製造のルーティンとして、大量培養装置を動かしているのは当社とFDIのみです。それ以外の工程は基本的には共通です。
質疑応答:結合粒子や標識体を使っているユーザーについて
質問者:結合粒子について、御社と同じ結合粒子や標識体を使っているユーザーはいるのですか?また、そういった会社の中で、社名は出せないと思いますが、ほぼ私たちが知っているプレーヤーが基本的には御社のクライアントということでしょうか?
二宮:加工原料までそのまま使える顧客というと、IVDの会社では半分くらいしかおらず、残りの会社は抗体から使っていただくしかありません。ただし、抗体しか提供できない顧客にとって、当社はあまりメリットがないのではないかというとそうではなく、当社は完成品まで自社製造・開発しているというのが大きな強みです。
例えば、足元でホットな話題の一種にアルツハイマーがありますが、アルツハイマーを認識する抗体は富士レビオ以外のメーカーも多数扱っています。そのため、理屈でいうとどのメーカーの抗体を使っても診断薬は作れてしまいます。
ただし当社の場合、「ルミパルス」は最終製品用に最終のチューニングまで考えて開発、製造しているため、例えばA社はアルツハイマーの抗体を作っているものの抗体しか作っていないとすると、A社はラインナップの中でどれがよいかをお客さまに提案しづらいです。
我々の場合には、複数のラインナップの中で自分たちの製品に適合させて、すでに良い性能が出ていることを確認済みのため、「おそらくこれはいいものです」と言えます。「ルミパルス」がProof of Conceptのような位置付けで、お客さまに提案できます。そのため最終製品に適用しやすい抗体というイメージは持てると思います。
今のところ我々はCDMO事業を立ち上げたばかりですので、「ルミパルス」の商材をそのまま使うことを考えていますが、仮に「『ルミパルス』とは全然違う測定系を使っているものの、どうしても『ルミパルス』で使われている原料を活用した試薬を作ってくれないか?」などの要望があり、それがビジネスとしてポテンシャルがあるのであれば、どこかのタイミングで富士レビオの工場が「ルミパルス」で使わない原料をCDMO事業のクライアントに提供する可能性もあるとは思っています。
質問者:技術的な問題はないのですね?
二宮:製造という意味ではありません。我々のグループの中に受託開発を担っているFDJという会社がありますが、彼らはレシピを作っている会社です。レシピをお客さまに提供し、彼らがそのレシピを当社の工場に提供してくれれば、その顧客向けの試薬を作ることができます。将来、CDMO事業の新しいバリエーション、成長という意味では、そのようなところに乗り出していく可能性はあります。
質問者:FDJはグループ会社ですよね?
二宮:富士レビオ・ダイアグノスティクス・ジャパンといって、宇部と八王子に拠点があります。我々は生産ですので基本的にはCDMOの中のContract Manufacturingですが、FDJはContract Development、つまり開発を担っている会社です。
質疑応答:十勝帯広工場で生産している抗体や結合粒子の割合について
質問者:十勝帯広工場で生産している抗体や結合粒子は、富士レビオ全体で何割程度でしょうか? FDIが製造している部分もあると思いますが、何割程度になりますか?
二宮:先ほどご説明した標識体や磁性粒子など、基本的に生産チェーンの中にある「ルミパルス」用の加工原料は、十勝帯広工場で100パーセント製造しています。
アメリカのFDIも自分たちのクライアントの委託製造のみ行っています。したがって、それぞれが使用する部分は、各事業会社でほぼ100パーセントの製造を賄っています。
質疑応答:抗体製造のノウハウについて
質問者:「50年以上抗体製造を行ってきたノウハウで、その微細な違いを捉えることができる」という主旨のご説明があったと思いますが、具体的なノウハウが気になるところです。
例えば、将来的にCDMOの技術が他社に真似された時に、抗体製造の部分がおそらく一番差別化を図りやすいのではないかと思います。可能であれば他社との違いを詳しく教えてください。
二宮:繰り返しのご説明になりますが、抗体はマウスなどの動物が作ります。例えば、1つのウイルスをマウスに投与すると、抗体の候補になりそうなものが数百万種類できます。そこから目的とする抗体を釣り上げて、最終的に1つを選びます。「ルミパルス」の測定系に限定するわけではありませんが、この後の酵素をくっつける工程も考慮してどのような候補物質を釣り上げるかは完全にノウハウです。
例えば、多くの会社はウイルスのタンパク質のみを使って釣り上げていると思います。ウイルスに一部加工したものをつけて、当社の測定系に合うような抗体をセレクションするなど、我々のノウハウとして数多の条件設定が何十年も蓄積されています。この行為は、自社で完成品を製造している会社でなければ真似できないことだと考えています。
また、知的財産の管理という意味では、出来上がったハイブリドーマが外部に流出してしまえば、抗体の培養はいくらでもできてしまうというリスクがあります。したがって、細胞管理は厳密に行っており、お客さまから「自分のところでも作りたいからハイブリドーマを分けてくれませんか?」といったリクエストがあっても必ず断っています。
例えば、モノクローナル抗体自体でも特許を取ることは可能です。しかし、その場合はハイブリドーマを外部のセンターに寄託しなければならず、そこから第三者に流出する可能性は否定できません。あえて特許は取得せず、細胞を自社で厳密に保管しているということです。
重要なクローンは日本にある富士レビオの複数の拠点で保管していますが、アメリカでも保管し、万が一日本の工場で何かが起こった時には、すぐにアメリカで製造が開始できる体制を整えています。
質疑応答:リプレースの可能性について
質問者:ビジネスを拡大させるにあたり、「CDMOは開発から」というイメージが以前からあります。ご説明をうかがっていると、自前で保有している会社で、これまで製造していたものをリプレースすることがあるかもしれないと思いましたが、その考えは間違いでしょうか?
二宮:それは、お客さまの製品を我々の原料にリプレースするということですか?
質問者:そのとおりです。
二宮:実はいくつかのCDMO案件ですでに行っています。我々の原料を使ってまったく新しい製品を製造しようとするお客さまもいますが、お客さまが自社で保有している製品の性能に満足できず、我々の原料に切り替えようというお客さまもいます。
例えば、腫瘍マーカーにAFP(α-フェトプロテイン)という項目がありますが、こちらはすべてのIVDメーカーが保有しています。それが商材にならないかといえばそうではなく、自社製品の性能に不満を持っているお客さまもいるため、我々の原料に切り替えれば性能が上がると確認できればリプレースします。したがって、現在お客さまがその製品を保有しているか否かは大きな制約にはなりません。
質問者:CDMOビジネスにおいて、新規とリプレースでは、圧倒的に新規が多いのでしょうか?
二宮:そうとも言えません。実際に、現在走っている案件やお客さまの種類はお伝えできかねますが、例えば富士レビオは昔から感染症に強いと言われています。B型肝炎やC型肝炎に対して、「ルミパルス」製品の性能が優れているのは周知の事実です。
したがって、我々が他社にCDMOを紹介した時に、富士レビオが持っているパイプライン、つまり「ルミパルス」としてすでに樹立している性能もしくはブランドがお客さまの興味の対象かどうかが大きく関わってきます。
例えば、感染症の製品を保有しているものの、強い不満を持っているお客さまだとすれば、感染症のリプレースに興味があるかもしれません。逆に、性能は既存のラインナップで満足しているもののNeurology項目が欲しい場合は、新規の製品として我々にオファーしていただけるかもしれません。そのため、新規とリプレースのどちらがメジャーかは断言できません。
質問者:基本的なことかもしれませんが、お客さまがすでにラインナップとして持っている製品の中で、御社の製品のほうがよさそうと思うことがあるかと思いますが、その場合も抗体は同じものを使っているということですか、それとも違う種類ですか?
二宮:お客さまは、我々以外の会社から抗体を購入して原料として使っているため、同じではありません。我々にリプレースすることで最終製品の性能は上がりますが、我々が提供する原料とお客さまがこれまで使っていた原料は基本的に違います。
質問者:原料が違うというのは、何百万種類以上もあり、タイプがさまざまに分かれているということでしょうか?
二宮:先ほど、「優れた抗体を取るノウハウはありますか?」というご質問がありましたが、例えばがんのマーカーで考えれば、基本的には、がんの抗原を認識するという機能はどのメーカーでも同じです。
ただし、我々が釣り上げてきた抗体は、他のお客さまが使っている抗体よりも性能や特異性、感度に優れています。したがって、タイプというより「ターゲットとする抗原にどれだけ強く結合するか」などのパフォーマンスにおいて、我々の抗体が優れているケースが多いということです。
質問者:抗体の名前はわかりませんが、物質名は同じでもより性能が優れているということでしょうか? それとも物質名が違うのでしょうか?
二宮:基本的に抗体はまったく同じで、性能がよいということです。このあたりは、伝わりづらい領域ですので、ご説明が難しく申し訳ありません。
質問者:リプレースするのであれば、おもしろいビジネスチャンスだと思います。「新規では難しいかな」と思っていたのですが、置き換えができるのであれば、可能性が広がると思います。
二宮:おっしゃるとおりです。現在、富士レビオは研究開発に尽力しています。毎年行われている臨床化学会などの学会で、この5年は毎年のようにアワード(Award)を獲得しています。このようなIVD事業を行っている会社は他にはありません。アワードの獲得は基本的に周知の事実となりますし、「富士レビオはアワードを獲得するくらいの技術を持っているから、この項目は富士レビオのほうがよいのでは?」となるのは容易にイメージできます。
お客さまは、「ルミパルス」の長年の実績や最近の研究開発の学会発表、アワードにより当社の項目に興味を持ちます。それがお客さまが持っている抗体や製品だとしても、当社のほうがよさそうだと思えばリプレースを決断していただけます。
質問者:川上は原料というイメージがありますが、研究拠点は八王子でしょうか?
二宮:おっしゃるとおりです。
質問者:よい抗体を探す作業は八王子で行っているのですか?
二宮:はい、八王子で研究を行っています。
質問者:一方、帯広はあくまでも生産拠点ですか?
二宮:そのとおりです。釣り上げる技術や、実際に釣り上げて最終的に「この抗体だ」と決めるのは開発です。
ただし、彼らは試験管レベルのスケールでしか検討しないため、我々は品質等に影響が出ないようにスケールアップして増産します。その部分を我々が担っているため、レシピの基本的な部分は研究開発が作らなければ製造できません。
料理で例えると、R&Dは小さじ0.1杯のものしか作りませんが、我々は計量カップ100杯のものを作るといった違いがあります。したがって、スケールアップの工程を作るところからは我々が行います。
質疑応答:スケールアップの難易度について
質問者:スケールアップの難易度に関してお考えを聞かせてください。機器を増やせばスケールアップが比較的簡単になるのでしょうか? それとも速度的なものが難しいというお話がありましたので、その難しさについて教えてください。
二宮:品質的に作れるか作れないかで言えば、難易度はほとんどないと考えています。ただし、バイオリアクターの性能を100パーセント発揮するレベルにまで効率を高めながらスケールアップすることに関しては、それなりの難易度があります。
我々は十勝帯広工場においてバイオリアクターの作業経験を重ねることで、ノウハウを獲得するつもりです。一方で、実はアメリカのFDIが10年以上バイオリアクターを使用した製造を続けています。最新のバイオリアクターのモデルは、FDIが使用しているものとまったく同じです。したがって、FDIから培養の条件を教えてもらえれば、基本的には同じレベルの生産ができるということです。
ただし、培地や試薬など、手に入るものがアメリカと日本で若干違います。日本で手に入る材料に合わせた最終的なチューニングは必要ですが、ある一定レベルまではFDIの条件を踏襲することでクリアできると考えています。2社協業体制の中で、そのようなスケールアップのリスクは低減できると思います。
質疑応答:生産全体の考え方について
質問者:生産体制全体の考え方についてです。宇部工場と十勝帯広工場ともに原料の生産を行っていると思いますが、重複しているところに関してどのような考えをお持ちでしょうか?
また、富士レビオのWebサイトに掲載されているビデオでも出てきたように、新型コロナウイルスへの対応において、旭川工場を短期間のうちに立ち上げましたが、今後はアフターコロナの時代に入る中で、生産全体の考え方について教えてください。
二宮:特にアフターコロナに関しては、我々もまだ手探りの部分があります。昨年と比較すると、今年はコロナ関連製品の生産が落ちていますが、今後の感染の収束度合いや、市場における新型コロナウイルス診断薬の必要性は予測がつきません。したがって、現在アフターコロナに関しての確実な戦略はありません。
ただし旭川工場は、「エスプライン」専用工場となっています。当社は新型コロナウイルス以外の梅毒やB型肝炎などの「エスプライン」簡易キットも作っています。こちらは安定的な需要があるため、基本的には旭川工場に「エスプライン」の製造を集約し、効率よく運用したいと考えています。
また、宇部工場では「エスプライン」を作りつつ、今後のCDMOの原料も増産しなければなりません。したがって、現在の建物も含め、リソースをうまく活用するのであれば、例えば旭川工場に「エスプライン」の製造を集中させ、宇部工場の余力部分にCDMOの原料の製造を入れることで、CDMOの生産性を上げながら「エスプライン」の生産をキープする戦略が可能性としてあります。
質疑応答:十勝帯広工場で生産する品目数について
質問者:簡単な数字の話です。御社グループでは、CDMOの製造品目数が年間5品目のペースで増えていくイメージと理解しています。当然ながらFDIと合わせた数ですので、十勝帯広工場で作る品目の数は今後どのようなペースで増えていくのでしょうか?
二宮:年間5品目という数字は、受託製造を含むパートナーシップで膨らむ数字だと思います。それとは別に、CDMOのビジネスの範疇では、抗体のみを販売しているお客さまの数がはるかに多いです。したがって、十勝帯広工場の品目が受託製造パートナーのポーションをどの程度占めるかは、お客さまとの今後の交渉次第です。
最初のセッションでもお話ししたとおり、抗体を提供する試薬のCDMOビジネスにおいて、FDIがクライアントに提供している一部は十勝帯広工場で作った原料を使っています。そのため、全体のパイプラインの中でも、それだけで終わりではありません。より多くの品目において、裏で支えている抗体を販売することや、その抗体をグループのパートナーとしてFDIに供給する取り組みも始まっています。
質問者:昨年10月に始まった1品目は、CDMOとしての品目ですか?
二宮:そのとおりです。富士レビオが獲得したパートナーに対し、CDMO原料として初めての出荷になります。これまでも、FDIがパートナーに提供するための原料はグループ内で供給してきましたが、コマーシャルクライアントへの出荷第1号になります。
質問者:現在何品目かはわかりませんが、1年が経過してどのようなペースで増えているのでしょうか?
二宮:具体的な数字はお伝えできませんが、昨年10月に最初の製品を出荷してからこれまでの間に、すでに5品目から6品目を追加で出荷しています。そのような意味では、今後かなりのペースで増えていくと期待しています。
質問者:今後も同様のペースで増えていくイメージですか?
二宮:セールスサイドがどこまでお客さまを獲得してくれるかにもよりますが、予測やフォーキャストという意味では、かなりの成長を見込んでいます。
質疑応答:現状のキャパシティでの生産対応について
質問者:試薬の性質によっても変わってくると思いますが、現在の工場稼働率のイメージとCDMOの増え方でいえば、どの程度まで現状のキャパシティで対応できるとお考えですか?
二宮:稼働率についての具体的な数字はお伝えできませんが、これまでの生産量の10倍は製造する想定で、十勝帯広工場の改修・増築を行っています。まだ10倍には届いていないため、設備の稼働率という意味では低い状態です。逆にいえば、設備稼働率を上げることで生産量を伸ばせる余地があります。
一方、人的稼働率という意味では、増員しすぎて人的稼働率が低くなれば、人件費を含んだコストはネガティブインパクトになります。増員は、例えば1年後、2年後、3年後に想定される製造量を考えながら行っているため、人の稼働率はかなり高いと思います。
質問者:そうすると、今後CDMO事業が伸びていくにあたって、生産サイドでボトルネックになるとは考えにくいということですか?
二宮:そのとおりです。
質疑応答:従業員数について
質問者:従業員数は、想定として100人程度まで増やしていくイメージですか?
二宮:おっしゃるとおりです。現在は約四十数名で、工場をフル稼働させようとすると、最終的には80名から90名のイメージです。工場を増やすとなれば、さらに多くなりますが、80名から100名のターゲットをイメージしています。
質疑応答:工場見学の有無と見学の際に感動を与えるものについて
質問者:十勝帯広工場について、CDMOの契約を結ぶにあたり、パートナーが実際に工場には見学に来られるのですか? そのような方はどこに感動されるのでしょうか?
二宮:事前に見学に来ることはありません。ただし、実際にディールが成立して契約した場合、先方は我々の製造行為に関して、記録の確認といった監査をする権利を持ちます。その場合は一定の頻度で、取引先監査に来ることはあると思います。
先方に感動を与えるものについて、我々は医薬品の製造工場ですので、医薬品の製造レベルの品質管理を行っています。例えば、抗体のみを販売しているメーカーには、医薬品レベルの品質管理システムも持っていない可能性があります。ただし、我々は診断薬といった医薬品を作っているため、品質記録や品質管理の体系は、まさに医薬品製造メーカーレベルです。
したがって、記録やバリデーションの方法について我々が提供した時に、「ここまでやってくれているんだ」という安心感を先方に与えられると思います。
質疑応答:土地の活用について
質問者:本日いただいた資料の最後に将来に向けて新規の土地を取得したというご説明があります。こちらに関して、具体的にどのような用途を想定しているのかお聞かせください。
二宮:明確な使い方は決めていませんが、向かい側とはいえ、工場が飛び地になると効率が悪くなるのは自明のことです。
例えば、現在の工場の前は駐車場になっています。敷地の3分の1程度が駐車場のため、この駐車場を新しく取得した土地に移してしまえば、すべて工場設備にできます。単純にいえば、面積レベルでも現在の十勝帯広工場の3倍近くまでは生産量を上げることができます。
したがって、新規に取得した土地に別棟の工場を建てるより、現在の建物をさらに拡張し、できるだけ生産性効率を高めながらキャパシティを増やすのが妥当だと考えています。
質疑応答:「ルミパルス」以外の試薬製造の準備期間について
質問者:「『ルミパルス』試薬以外の試薬を製造するかもしれない」というお話があったと思います。それを製造するとしたら、期間はどの程度かかるのでしょうか?
二宮:例えばFDIはすでに「ルミパルス」以外の他社のパートナーの試薬を製造しています。基本的な作り方は大きく変わりません。レシピさえ手に入れば、別の会社の試薬も同じ設備で作ることができると思います。
ただし、クライアントの試薬と自社品を同じところで作る場合、物理的な面、機密の保持性、お客さまに対する安心感などの観点から場所を分ける必要があります。工場に他社製品を製造するための場所を確保し、製造室を整備するといった期間がかかります。
先ほどの話につながりますが、例えば「エスプライン」の製造を旭川工場に集約できるのであれば、現在の宇部工場の製造室をすぐにでも他社製品の製造に転用することが可能性としてあると思います。その意思決定ができれば、他社製品を作ることが決まってから1年足らずで製造が立ち上げられると思います。
質問者:人的リソースなどに特に問題はありますか?
二宮:製造工程が「ルミパルス」の試薬の製造と非常に似通っているため、現在の製造スタッフである程度のところまでは対応できると思います。
質疑応答:リプレースのチャンスについて
質問者:リプレースについて、相手の製品がリニューアルする時がチャンスになるかと思いますが、そのようなタイミングはあるのでしょうか?
また、そのように原料を変えると、ユーザーは承認を取り直さなければならず、1年とか時間がかかるものなのでしょうか?
二宮:各国の規制によって異なるとは思います。日本では、1年レベルで済むものであれば、再申請などの一連の工数はかからないものの、新規で承認を取得するとなると、お客さまにとってもかなりの負担になります。したがって、お客さまが抱えているマーケットで、変更の難易度が高いかによって、興味の度合いや意思決定の出し方が変わってくると思います。
ただし、例えば我々の原料を使うことで感度が10倍上がるとなると、お客さまの市場で絶対的な競争力が上がるため、「再申請をしても富士レビオにリプレースしよう」というモチベーションになると思います。
我々は「iTACT」など、さまざまな新しい原理の試薬を世の中に供給していますが、それを自社製品に適用できれば性能が上がるとお客さまが実感すれば、申請に労力を費やしてでも変更するモチベーションになると思います。
質問者:感度が10倍上がることはありますか?
二宮:例えば、我々はB型肝炎の「HQ」という製品を以前から出していますが、他社と比較すると、10倍とまではいきませんが、感度が数倍高いです。
関連銘柄
| 銘柄 | 株価 | 前日比 |
|---|---|---|
|
4544
|
3,255.0
(14:08)
|
-67.0
(-2.01%)
|
関連銘柄の最新ニュース
-
01/14 15:30
-
01/09 10:00
-
2025/11/28
-
2025/11/26
-
2025/11/25
新着ニュース
新着ニュース一覧-
今日 14:23
-
今日 14:15







